электролита в водном растворе (или расплаве) на ионы
Электролиты (М.
Фарадей, первая половина XIX в.) - вещества, растворы или расплавы которых проводят электрический ток
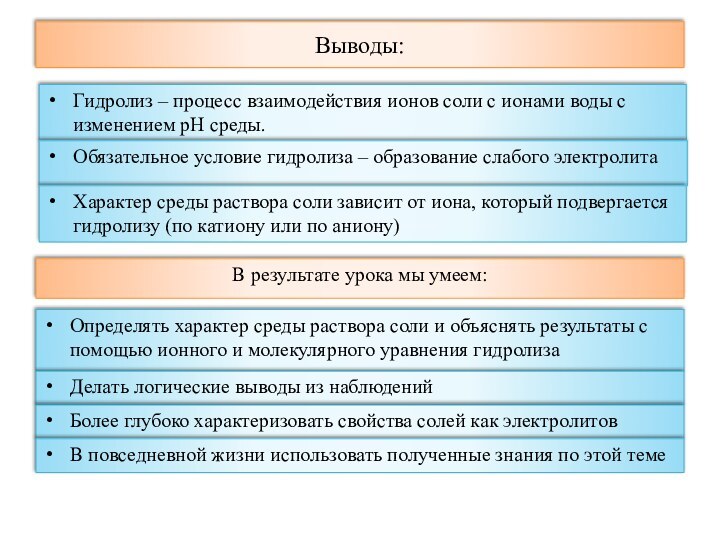
Степень диссоциации (α) -
отношение концентрации распавшихся при диссоциации ионов к общей
концентрации вещества (выражают в %)
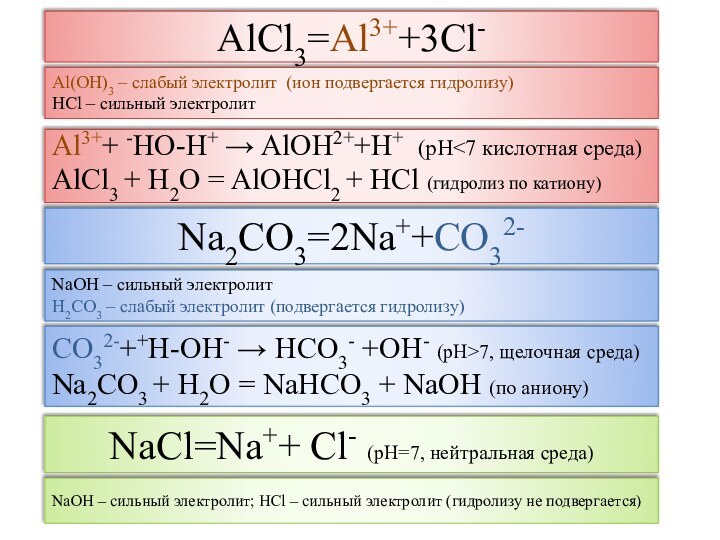
Соли (с точки зрения ТЭД) -
электролиты, при диссоциации которых образуются катионы металла и
анионы кислотного остатка
рН раствора -
отрицательный десятичный логарифм концентрации ионов водорода
рН = - lg[H+]
рН < 7 – кислая среда; рН = 7 – нейтральная среда; рН > 7 – щелочная среда