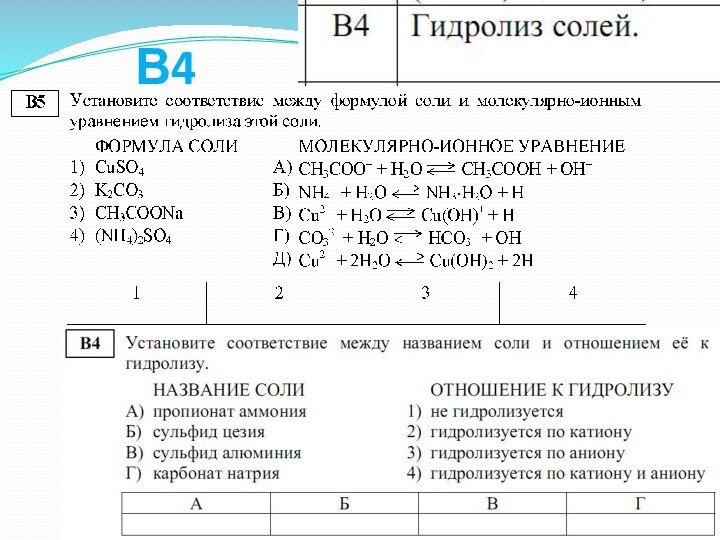
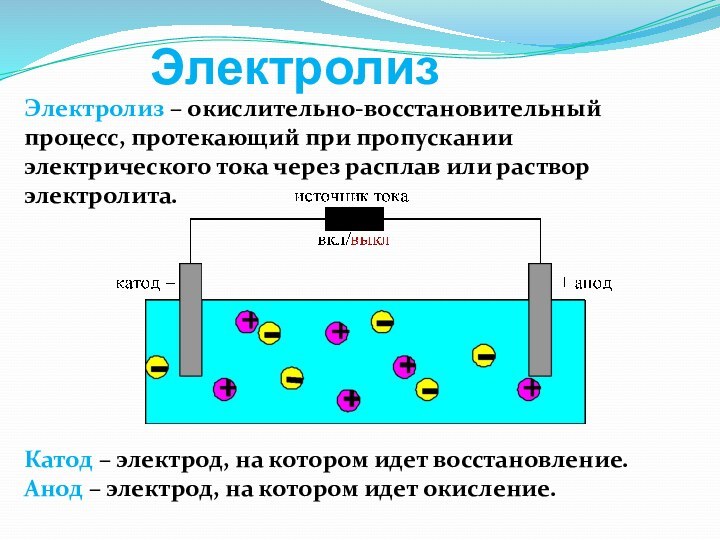
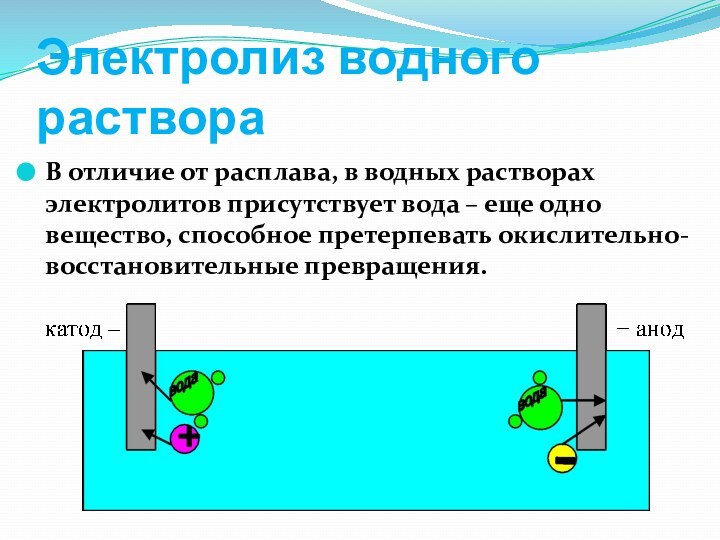
слабой кислоты или основания.
Соль образована сильной кислотой и слабым
основанием кислая средаСоль образована слабой кислотой и сильным основанием щелочная среда
(Что сильнее, то и пересиливает!)
Соль образована сильной кислотой и сильным основанием
нейтральная среда