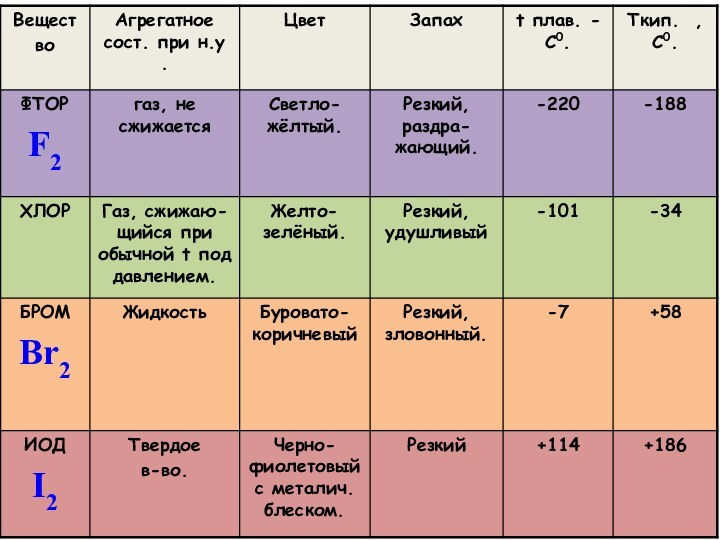
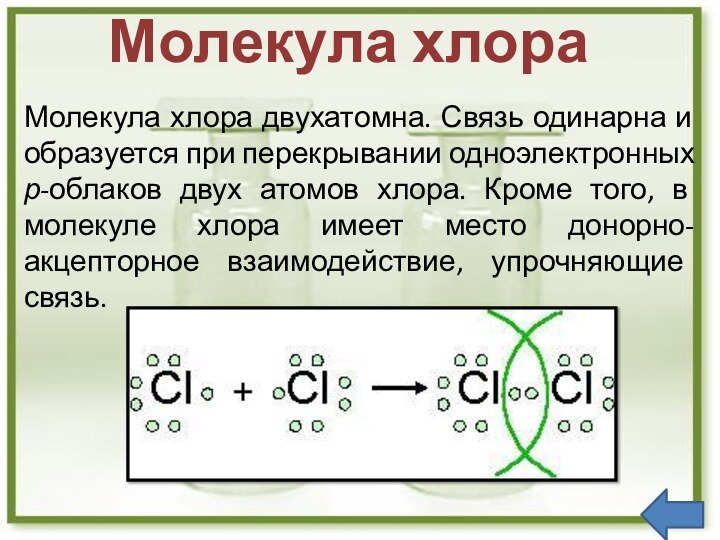
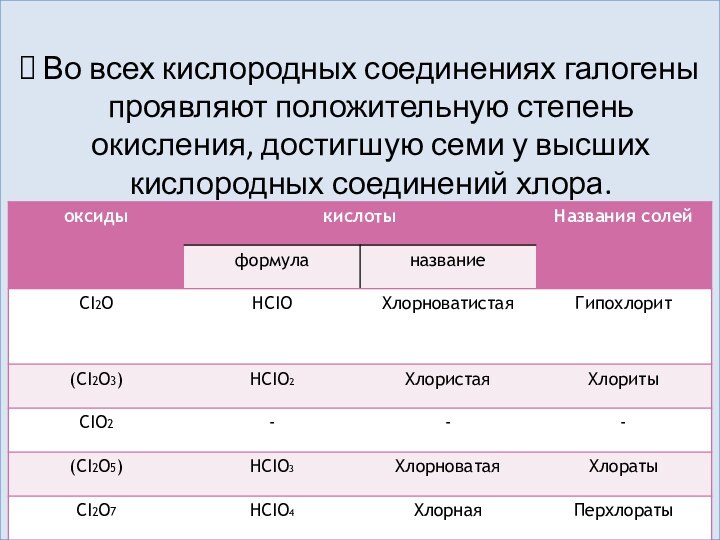
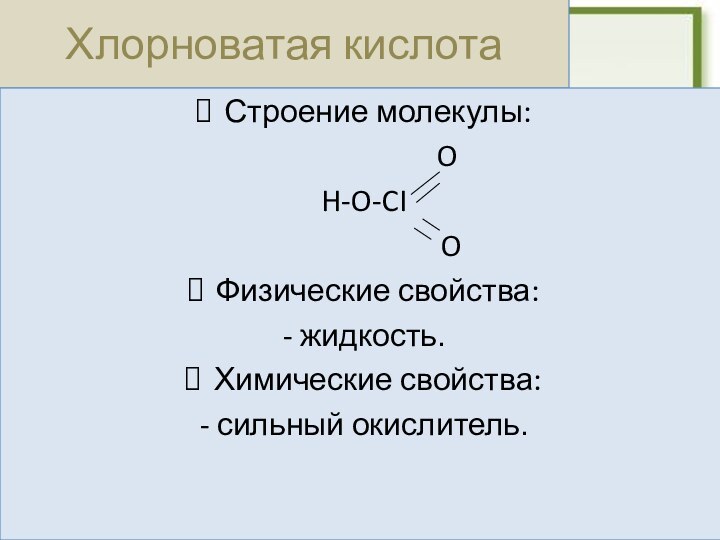
P
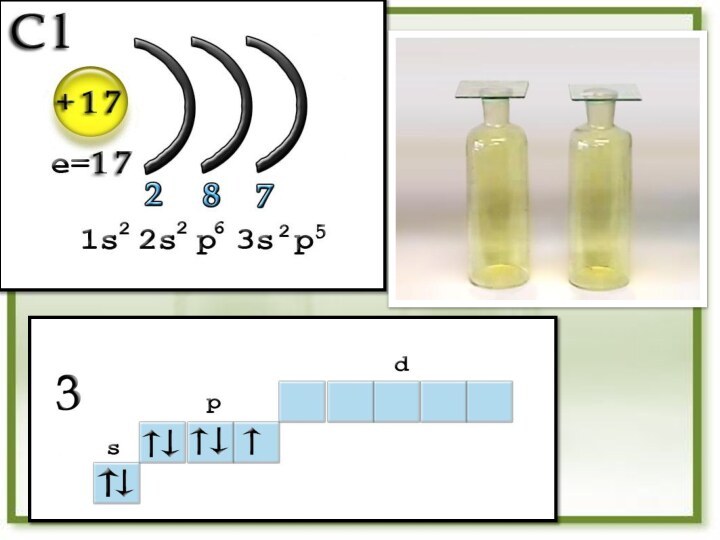
CI
1S22S22P63S23P5
Br
I
…4S24P5
…5S25P5
Электронные формулы
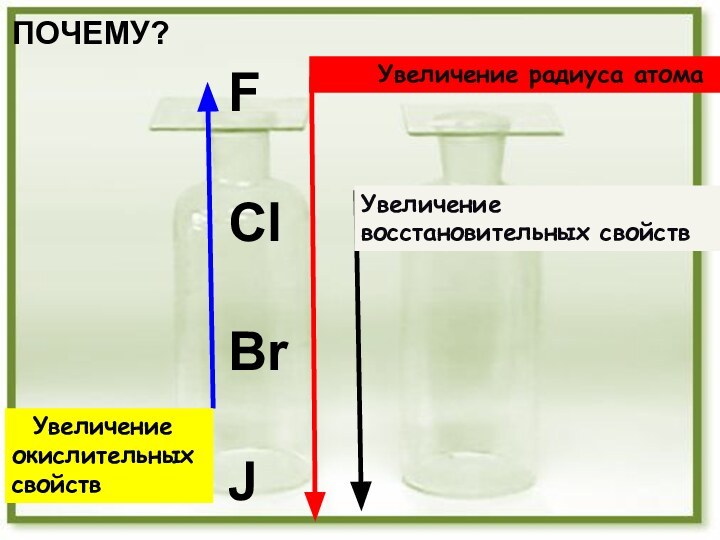
Вывод: галогены - р - элементы
На внешнем
энергетическомуровне 7 электронов, один из них неспаренный .
2
5