Слайд 2
Положение В периодической системе химических элементов
Д.И. Менделеева
Фтор
F
Порядковый номер – 9,
группа - VIIА,
период - 2, малый.
Слайд 3
Строение молекулы фтора
.. ..
:F : F:
¨ ¨
F—F
Вследствие малого радиуса атома фтора неподелённые электронные пары в молекуле фтора взаимно отталкиваются и ослабляют связь F-F .
Энергия диссоциации молекулы фтора равна
158,34 кДж/моль.
Активность молекулы фтора по сравнению с хлором выше.
Слайд 4
Нахождение фтора
в природе
Содержание фтора в литосфере составляет
0,066 масс. %. В свободном виде он не встречается
ввиду своей химической активности.
Фтор встречается в природе чаще всего в виде минералов криолита 3NaF∙AlF3 и плавикового шпата, или флюорита CаF2, получившего своё название потому, что его прибавляют иногда к железным рудам для образования легкоплавких шлаков при выплавке чугуна.
Значительное количество фтора содержится также в фосфорных минералах: фосфорите и особенно апатите.
Содержится он в организме человека и животных, например, в составе костей и зубной эмали.
Слайд 5
Физические свойства фтора
Агрегатное состояние – газ.
Цвет:
зеленовато-жёлтый.
Запах – резкий, раздражающий.
В воде не растворяется,
т.к. окисляет её.
Температура плавления - -218˚ С.
Температура кипения - -188˚ С.
Трудно сжижающийся.
Плотность 1,11.
Слайд 6
химические свойства фтора
Очень энергичный окислитель
- Взаимодействует с водой
- вода загорается в струе фтора бледно– фиолетовым пламенем
2F2
+ 2H2O → 4HF + O2
- Взаимодействует с кислородом
O2 + 2F2 → 2OF2
- Взаимодействует с инертными газами
2 F2 + Xe → XeF4
- Взаимодействует с водородом со взрывом
F2 + H2 → 2HF
- Вытесняет другие галогены из расплавов их солей
F2 + 2KBr → Br2 + 2KF
- Взаимодействует с оксидом кремния (IV)
SiO2 + 2F2 → SiF4 +O2
- Взаимодействует со щелочами и азотной кислотой
2F2 + 2KOH → OF2 + 2KF + H2O
2F2 + 2HNO3 → H2F2 + 2NO3F (триоксидфторид азота)
Слайд 7
Получение фтора
В лаборатории
2KF∙2HF(при 70˚) → 2K + H2
+ 2F2
Слайд 8
Правила техники безопасности при работе с фтором и
его соединениями
Фтор обладает очень резким запахом. Вдыхание даже
небольших количеств вызывает раздражение дыхательных путей и воспаление слизистой оболочки горла и носа. Более значительное количество фтора могут вызвать тяжёлое отравление организма.
Слайд 9
Применение фтора
Хладоагенты.
Фторопласты.
В состав лекарств.
Моющие средства.
Ядохимикаты.
В составе красителей.
В составе
компонентов искусственной крови.
Соединения фтора используются для производства зубных
паст.
Боевые отравляющие вещества нервно – паралитического действия – зарин и зоман.
Окислители ракетного топлива.
Слайд 10
Строение фтороводорода
Мономерные молекулы HF существуют в газообразном фтороводороде
лишь при высоких температурах, а в обычных условиях даже
газообразный фтороводород представляет собой полимерные молекулы, образованные за счет водородных связей, например, молекулы H6F6 , имеющие циклическое строение. Жидкий фтороводород(HF)n состоит из ассоциированных молекул:
F F F
H H H H
Слайд 11
Физические свойства фтороводорода
- Дымит на воздухе.
- Едкий газ
с резким запахом.
- Хорошо растворим в воде.
Его раствор представляет
собой
фтороводородную (плавиковую) кислоту
средней силы.
- Сжижается при 19,5˚ С.
- Удельный вес (плотность) 0,987.
- Температура плавления -83 ˚С.
- Температура кипения 19,5 ˚С.
- Теплота образования 267,5 кДж.
Слайд 12
Химические свойства фтороводорода
Фтороводородная кислота взаимодействует с большинством
металлов, кроме золота и платины
2АI + 3F2 → 2
AIF3
Качественная реакция на ионы фтора – взаимодействие с растворами, содержащими ионы кальция. При этом выпадает белый осадок
2HF + Ca(OH)2 → CaF2 + 2H2O
Взаимодействует с двуокисью кремния, входящим в состав стекла
SiO2 + 4HF → SiF4 + 2H2O
Слайд 13
Правила техники безопасности
Пары плавиковой кислоты очень ядовиты, вызывают
ожоги кожи, которые переходят в трудно заживающие язвы.
Хранят
её в сосудах из эбонита или воска, которые она не разрушает.
При отравлении фтороводородной кислотой предлагается принимать молоко, сливки, белок куриного яйца в большом количестве, а также раствор хлористого кальция из расчёта 10 г безводной соли на 200 г воды. Рвоту вызывать противопоказано. Необходимо доставить пострадавшего в медицинское учреждение.
Слайд 14
Применение фтороводорода
вытравливание на стекле рисунков, надписей;
для придания матовой
поверхности стеклянным предметам;
получение искусственного криолита;
катализатор при некоторых реакциях, например,
при производстве высококачественного моторного топлива;
для получения органических фторидов, применяемых в холодильных машинах;
для синтеза красителей, смазочных масел, пластмасс.
Слайд 15
Получение фтороводорода
Его получают из природного соединения фтора –
фтористого кальция
(плавикового шпата)
CaF2 + H2SO4
→ CaSO4 + 2HF
Слайд 16
Соли плавиковой кислоты называются фторидами.
Нерастворимы в воде, кроме
AgF, он легко растворим.
Фтористый натрий NaF применяется
для борьбы
с вредителями в сельском хозяйстве;
- в качестве консервирующего вещества для пропитки дерева.
Слайд 17
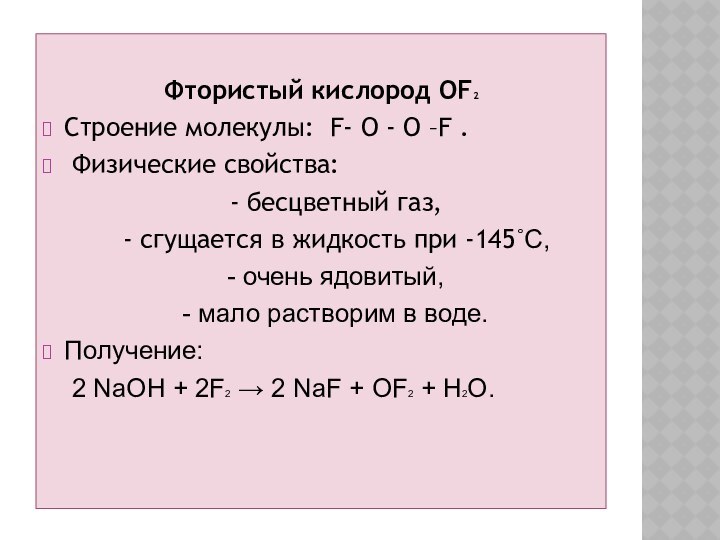
Фтористый кислород OF2
Строение молекулы: F- O - O
–F .
Физические свойства:
- бесцветный газ,
- сгущается в жидкость при -145˚С,
- очень ядовитый,
- мало растворим в воде.
Получение:
2 NaOH + 2F2 → 2 NaF + OF2 + H2O.
Слайд 18
Положение в периодической системе Д.И. Менделеева
Хлор
CI
Порядковый номер -17.
Группа – VIIA.
Период – 3 малый.
Слайд 20
Нахождение хлора в природе
В свободном виде в природе
не встречается, содержание хлора в литосфере 0,25масс.%.
Воды морей и
океанов содержат 0,8 – 3 % хлорида натрия; в результате их высыхания образовались отложения хлорида натрия, или каменной соли.
Важнейшие природные соединения хлора
каменная соль (NaCI),
сильвин KCI, сильвинит KCI.NaCI,
карналлит KCI∙MgCI2∙6H2O,
хлорид магния MgCI2.
Слайд 21
ФИЗИЧЕСКИЕ СВОЙСТВА хлора
Газ.
Плотность – 1,57.
Температура плавления -101˚С.
Температура
кипения – 34˚С.
Жёлто–зелёный.
Характерный хапах.
Тяжелее воздуха в 2,5 раза.
1л
весит 3,21 г.
Превращается в жидкость при обычной температуре и давлении 6 атм.
Малорастворим в воде (раствор называется хлорной водой).
Слайд 22
Правила техники безопасности
Хлор раздражает слизистые оболочки дыхательных путей,
вызывает жжение во рту и кашель. Вдыхание больших количеств
хлора приводит к удушью.
При отравлении хлором пострадавшего следует срочно вывести на свежий воздух, либо перенести в хорошо проветриваемое помещение. Дать дышать чистым кислородом. На грудь и горло следует поместить холодные компрессы. Срочно вызвать врача.
Слайд 23
Химические свойства хлора
1) Различным сродством к электрону хорошо
объясняется вытеснение одних галогенов другими из их соединений. Так
как сродство фтора к электрону наибольшее, то он может отнимать электроны от ионов любых галогенов; хлор отнимает электроны только от ионов брома и йода
CI2 + 2KI → I2 + 2KCI.
Химическая активность молекул галогенов как окислителей убывает в следующем порядке:
F2 > CI2 >Br2 >I2 .
Восстановительные свойства ионов галогенов убывают в обратном порядке.
Слайд 24
2) Является чрезвычайно активным элементом
Взаимодействует с металлами
2
Na + CI2 → 2NaCI.
Энергичный
окислитель
2 FeCI2 + CI2 → FeCI3 .
3) Хлор взаимодействует с водородом на свету со взрывом
Эта реакция состоит из множества отдельных стадий. Поглощая энергию солнечных лучей, отдельные молекулы хлора распадаются на атомы:
СI2 + hν = 2CI ۠
Атомы хлора более активны, чем молекулы, и немедленно вступают во взаимодействие с молекулами водорода по уравнению
CI ۠ + H2 → HCI + H ۠
Образующиеся атомы водорода, в свою очередь, реагируют с молекулами хлора, вызывая образование новых атомов хлора:
H ۠+ CI2 → HCI + CI ۠
Последние опять вступают в реакцию с молекулами водорода и т.д. (цепные реакции).
Слайд 25
Взаимодействует с другими неметаллами
2P +3CI2 = 2PCI3
2P
+ 5CI2 = 2PCI5
CI2 + H2O ↔ HCI +
HCIO
Взаимодействует с щёлочью
2KОН + СI2 = KCI + KCIO + H2O
(жавелевая вода)
2Сa(OH)2 + 2CI2 = Ca(CIO)2 + CaCI2 + 2H2O
(белильная или хлорная известь)
Хлор не взаимодействует с кислородом, азотом и углём (их соединения получаются косвенным путём).
Слайд 26
Взаимодействует с органическими соединениями:
- с предельными углеводородами по
цепному свободно радикальному механизму
Под действием света молекула хлора распадается
на радикалы:
CI2 ↔ 2CI∙
Неорганический радикал отрывает от молекулы метана атом водорода с одним электроном, образуя HCI и свободный радикал СH3∙.
Свободный радикал взаимодействует с молекулой хлора, образуя галогенопроизводное и радикал хлора.
Радикал хлора снова продолжает цепь превращений и т.д.
Слайд 27
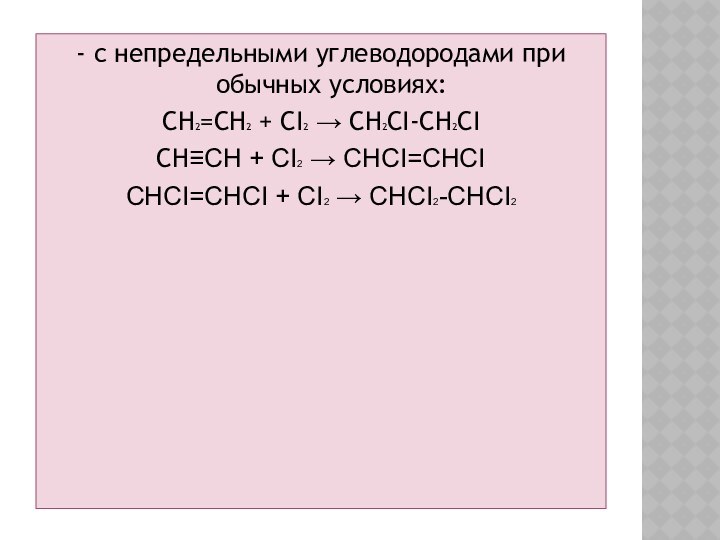
- с непредельными углеводородами при обычных условиях:
CH2=CH2 +
CI2 → CH2CI-CH2CI
CH≡CH + CI2 → CHCI=CHCI
CHCI=CHCI + CI2
→ CHCI2-CHCI2
Слайд 28
Получение хлора
В промышленности
электролиз водных растворов хлористых солей натрия
или калия
K (-): 2H2O + 2e = H2 +
2OH¯
А (+): 2CI¯ - 2е = CI2
-----------------------------------------------------------------------------------------
электролиз
2H2O + 2CI¯ → H2 +CI2+ 2OH¯
В лаборатории
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O
4HCI +O2 ↔2CI2 + 2H2O (при t =400˚C)
Слайд 29
Применение хлора
Служит для приготовления многочисленных неорганических соединений:
- соляной
кислоты;
- хлорной извести;
- гипохлоритов;
- хлоратов;
- хлористой серы;
-
в виде белильных солей для отбелки тканей и целлюлозы;
- для стерилизации питьевой воды;
- для обеззараживания сточных вод;
- в цветной металлургии для получения некоторых металлов путём хлорирования их руд.
Слайд 30
Для получения органических веществ:
- органических растворителей – дихлорэтана,
четырёххлористого углерода и др.;
- средств для борьбы с вредителями
сельскохозяйственных культур;
- пластмасс;
- синтетических волокон;
- высококачественных каучуков;
- заменителей кожи.
Слайд 32
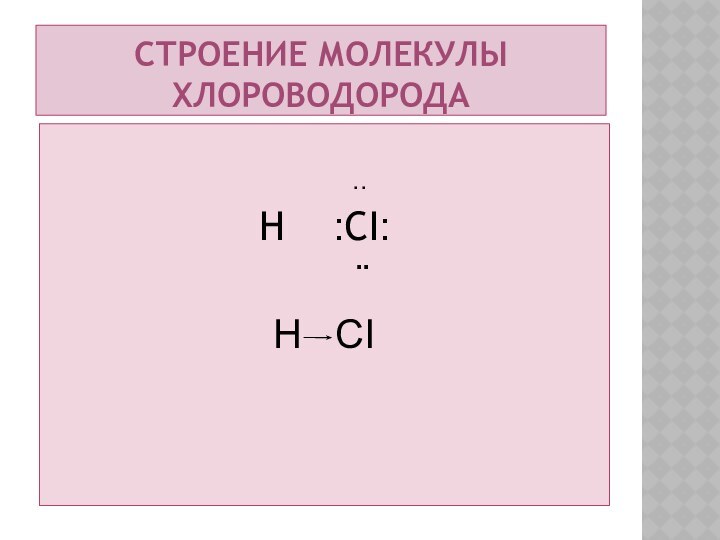
Строение молекулы хлороводорода
..
H
:CI:
¨
H CI
Слайд 33
физические свойства хлороводорода
- газ;
- без цвета;
-
с резким запахом;
- легко обращается в жидкость;
- хорошо растворяется
в воде (в 1л воды 500л хлороводорода);
- температура плавления -112˚С;
- температура кипения -84˚С.
- К нагреванию менее устойчив по сравнению с фтороводородом, но более устойчив в сравнении с бромоводородом и йодоводородом.
Слайд 34
Правила техники безопасности
При попадании кислоты на кожу капли
стряхивают, смывают водой в течении
7-10 мин, промывают поражённое место
5-10 % раствором гидрокарбоната натрия, ополаскивают и накладывают стерильную повязку.
При попадании внутрь пострадавшему необходимо срочно дать взвесь жжёной магнезии. Молоко, сливки, белок куриного яйца могут оказаться также очень эффективными. При стеснённом дыхании необходимо применить искусственное дыхание. Вызывать рвоту противопоказано.
Слайд 35
Получение хлороводорода
В промышленности:
действие концентрированной серной кислоты
на соли галогеноводородных кислот
2NaCI + H2SO4 = Na2SO4 +
2HCI
(при очень сильном нагревании).
Слайд 36
Соляная кислота
Получение:
- растворением хлороводорода в воде;
-
синтез путём сжигания водорода в струе хлора H2
+ CI2 = 2HCI + 183,1 кДж.
Физические свойства:
-жидкость;
- бесцветная;
- с резким запахом.
Слайд 37
Химические свойства:
- легко вступает во взаимодействие с
металлами, выделяя водород и образуя соли – хлориды
Zn +
2HCI = ZnCI2 + H2
- взаимодействует с основными оксидами
CuO + 2HCI = CuCI2 +H2O
- взаимодействует с основаниями
AI(OH)3 +3HCI = AICI3 +3H2O
-взаимодействует с солями
AgNO3 + HCI = AgCI +HNO3
- взаимодействует с аммиаком с образованием солей аммония
NH3 +HCI = NH4CI
- взаимодействует с хлорной известью
Ca(CIO)2 + 4HCI = CaCI2+2CI2 +2H2O
Слайд 38
Применение хлороводорода:
- для получения солей – хлоридов;
- при травлении металлов;
- в пищевой промышленности;
-
в медицине.
Слайд 40
Во всех кислородных соединениях галогены проявляют положительную степень
окисления, достигшую семи у высших кислородных соединений хлора.
Слайд 41
Получение:
CI2 + H2O ↔ HCIO + HCI.
Эта реакция представляет собой не что иное, как гидролиз
хлора. Гидролизу предшествует поляризация ковалентной связи между атомами хлора в молекуле CI2, т.е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [CI]¯.Гидролиз хлора является окислительно–восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Свойства :
очень неустойчива :
2HCIO = 2HCI + O2
- очень сильный окислитель; её образованием при взаимодействии хлора с водой объясняются белящие свойства хлора;
- образует соли – гипохлориты;
- взаимодействует с щелочью
HCI + HCIO + 2KOH = KCI + KCIO + 2H2O.
Хлорноватистая кислота
Слайд 42
- Смесь солей хлорноватистой и соляной кислот называется
жавелевой водой и применяется для беления:
KOH + CO2 +
H2O = KHCO3 + HCIO
- Гипохлорит кальция (Ca(CIO)2)- белильная или хлористая известь применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и т.д., для дегазации местности, заражённой отравляющими веществами.
Гипохлориты – соли хлорноватистой кислоты
Слайд 43
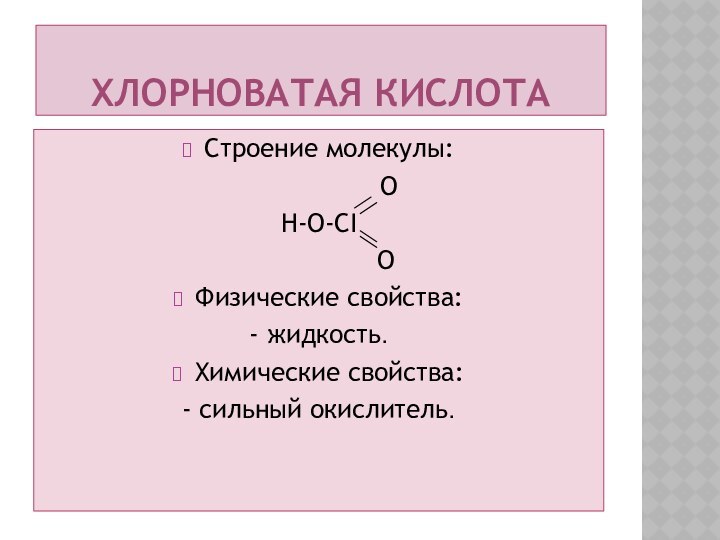
Хлорноватая кислота
Строение молекулы:
O
H-O-CI
O
Физические свойства:
- жидкость.
Химические свойства:
- сильный окислитель.
Слайд 44
Получение хлората калия:
3KCIO = KCIO3 +
2KCI (при нагревании)
6KOH +3CI2 = 5KCI + KCIO3 +3H2O
(горячий р-р)
Свойства хлората калия:
при нагревании разлагаются
2KCIO3 = 2KCI + 3O2 .
(бертолетова соль)
Образует смеси, сильно взрывающиеся при ударе, с горючими веществами (серой, углём, фосфором).
Применение бертолетовой соли:
в артиллерийском деле,
пиротехнике,
производстве спичек.
Хлораты -
соли хлорноватой кислоты
Слайд 45
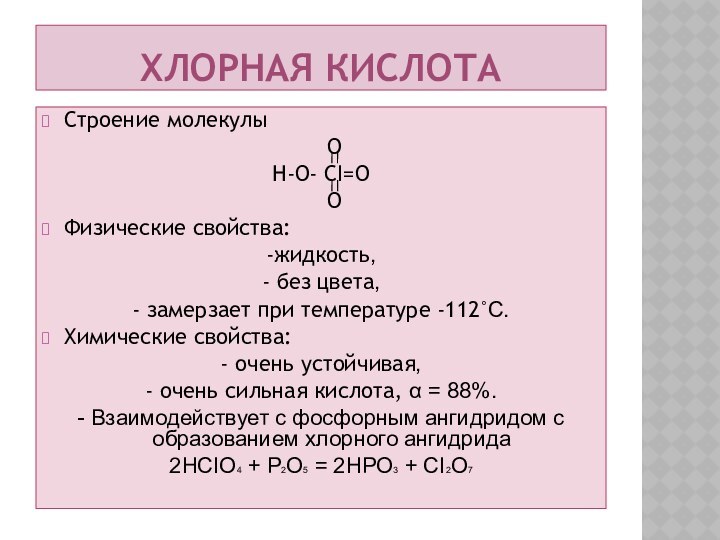
Хлорная кислота
Строение молекулы
O
H-O- CI=O
O
Физические свойства:
-жидкость,
- без цвета,
- замерзает при температуре -112˚С.
Химические
свойства:
- очень устойчивая,
- очень сильная кислота, α = 88%.
- Взаимодействует с фосфорным ангидридом с образованием хлорного ангидрида
2HCIO4 + P2O5 = 2HPO3 + CI2O7