как о химическом элементе и простом веществе;
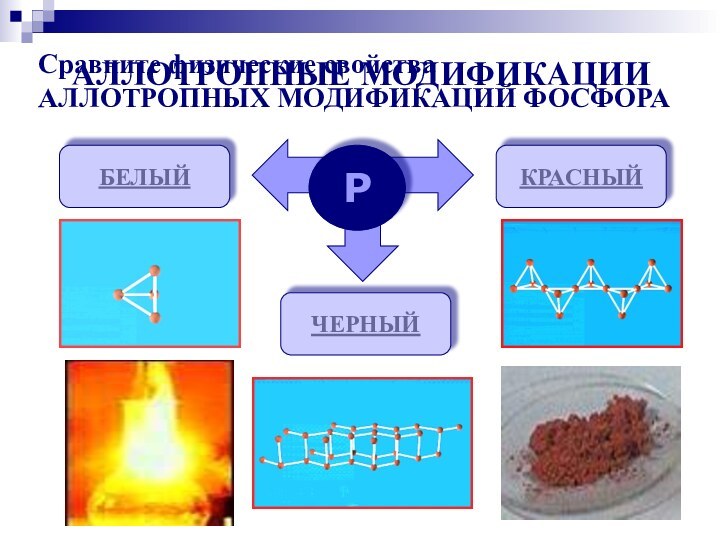
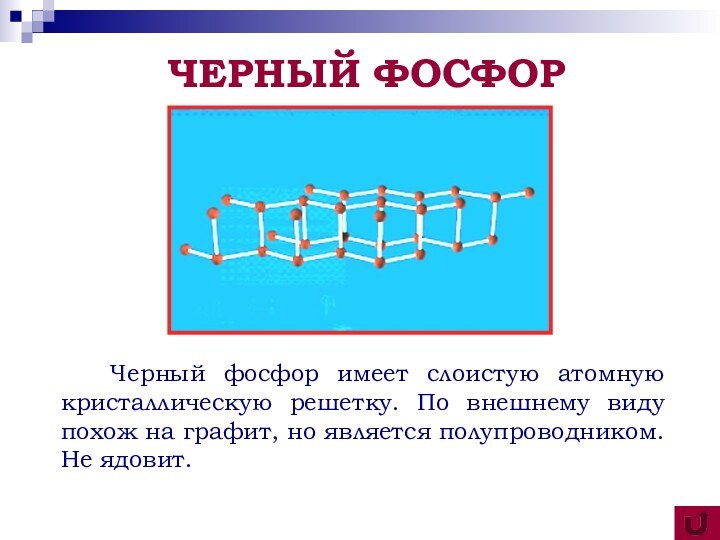
аллотропных видоизменениях
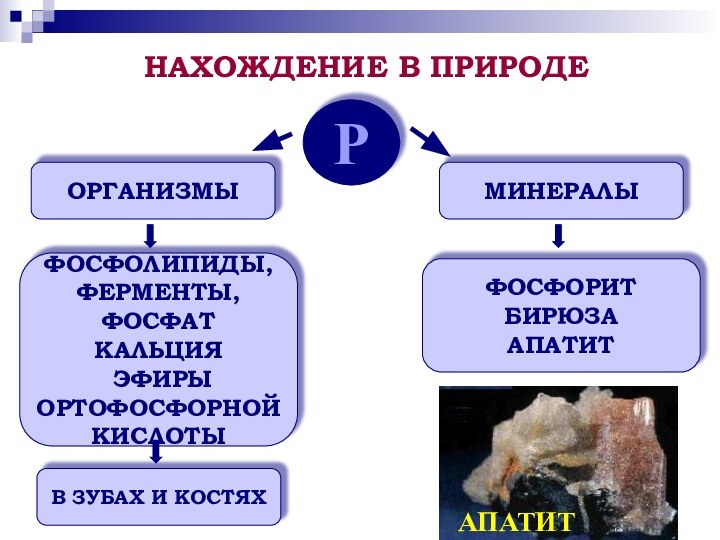
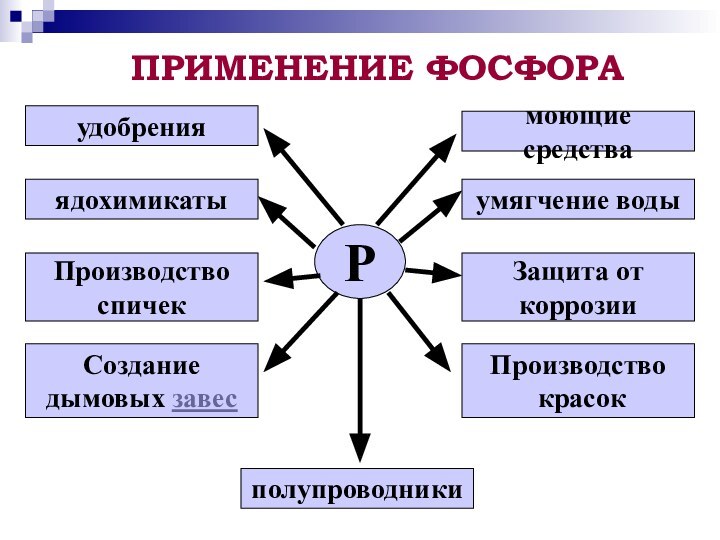
фосфора; повторить зависимость свойств вещества от его состава и строения;
развивать умение сравнивать;
способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.