Слайд 2
СОДЕРЖАНИЕ:
ПОНЯТИЕ О ФЕРМЕНТАХ
КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ УЧЕНИЯ О ФЕРМЕНТАХ
ХИМИЧЕСКАЯ
ИСТОРИЯ ФЕРМЕНТОВ
ОСНОВНЫЕ СВОЙСТВА ФЕРЕНТОВ
СТРОЕНИЕ ФЕРМЕНТОВ
АКТИВНЫЙ ЦЕНТР ФЕРМЕНТОВ
МЕХАНИЗМ ДЕЙСТВИЙ ФЕРМЕНТОВ
ПРИМЕНЕНИЕ
ФЕРМЕНТОВ
ПРОБЛЕМА МЕДИЦИНСКОЙ ЭНЗИМОЛОГИИ
Слайд 3
1.ПОНЯТИЕ О ФЕРМЕНТАХ
Ферменты

Ферменты, или энзимы Ферменты, или энзимы,
представляют собой высокоспециализированный класс веществ Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. И.П. Павлов считал ферменты Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. И.П. Павлов считал ферменты «возбудителями всех химических превращений» у живых существ. Как известно, важнейшим свойством живого организма Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. И.П. Павлов считал ферменты «возбудителями всех химических превращений» у живых существ. Как известно, важнейшим свойством живого организма является обмен веществ Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. И.П. Павлов считал ферменты «возбудителями всех химических превращений» у живых существ. Как известно, важнейшим свойством живого организма является обмен веществ, ускоряющим аппаратом, основой молекулярных механизмов интенсивности которого являются ферменты Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами. И.П. Павлов считал ферменты «возбудителями всех химических превращений» у живых существ. Как известно, важнейшим свойством живого организма является обмен веществ, ускоряющим аппаратом, основой молекулярных механизмов интенсивности которого являются ферменты. «Вся тайна животной жизни,– писал Д.И. Менделеев,– заключается в непрерывных химических превращениях веществ, входящих в состав животных тканей».
Слайд 4
2.КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ УЧЕНИЯ О ФЕРМЕНТАХ

Явления брожения Явления брожения и переваривания известны
с незапамятных времен, однако зарождение учения о ферментах Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты, в частности пепсин Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты, в частности пепсин и трипсин Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты, в частности пепсин и трипсин, вызывающие распад (гидролиз) белков в пищеварительном тракте.
Слайд 5
3.ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ
О белковой

природе ферментов О белковой природе ферментов свидетельствует
факт инактивирования (потеря активности) ферментов О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов и др.) происходит денатурация О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов и др.) происходит денатурация ферментов, так же как и белков .
Слайд 6
4.ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ

К ферментамферментам
применимы три основных критерия, характерных и для неорганических катализаторовферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекуламиферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстратаферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активностьферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферментыферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрацияхферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекулаферментам применимы три основных критерия, характерных и для неорганических катализаторов. В частности, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя нельзя исключить побочных влияний условий среды на активность фермента). Ферменты способны оказывать действие в ничтожно малых концентрациях (например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37°С). Наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия и отрицательной величиной ΔG принято называть экзергоническими. Реакции с низкой константой равновесия и соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндергоническими. Для начала и завершения этих реакций необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии.
Слайд 7
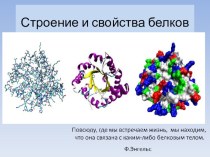
5.СТРОЕНИЕ ФЕРМЕНТОВ
В природе существуют

как простые, так и сложные ферментыВ природе существуют как
простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизеВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислотыВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментамиВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферментыВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсинВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсинВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреазаВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцимВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеазаВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатазаВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментовВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белковВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активностиВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочностиВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциацииВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного ферментаВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в раствореВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом.
Слайд 8
6.Активный центр ферментов
При изучении

механизма химической реакции При изучении механизма химической
реакции, катализируемой ферментами При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа. Установлено, что у сложных ферментов в состав активного центра входят также простатические группы.
Слайд 9
7.МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
До установления

химической природы ферментов До установления химической природы
ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышение скорости химических реакций До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышение скорости химических реакций под действием ферментов До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышение скорости химических реакций под действием ферментов объясняли следующим: а) активированием субстрата в результате образования адсорбционных или молекулярных, обратимо диссоциирующих фермент-субстратных комплексов; б) цепным механизмом реакцийфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекулфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакциифермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализефермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментовфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализефермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе ферментфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратомфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением ферментафермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекулфермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих в реакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента.
Слайд 10
8.ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Обладая высокой степенью

избирательности, ферменты Обладая высокой степенью избирательности, ферменты
используются живыми организмами Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров аминокислот Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов, несомненно, предоставит неограниченные возможности получения в огромных количествах и с большой скоростью полезных веществ в лабораторных условиях почти со 100% выходом.