- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ферменти
Содержание
- 2. Ферме́нти або ензи́ми — органічні каталізатори білкової
- 3. Історична довідкаТермін «фермент» був запропонований у 17
- 4. Історична довідкаПонад сто років тому терміни «фермент»
- 5. Ферменти наявні в усіх живих клітинах і
- 6. Спільне між ферментами та неорганічними каталізаторамиПодібно до
- 7. Відмінності ферментів і неорганічних каталізаторівНеорганічні каталізатори за
- 8. Порівняння ферментів і неорганічних каталізаторів3. Ферменти здатні
- 9. Порівняння ферментів і неорганічних каталізаторів4. Синтез та
- 10. Порівняння ферментів і неорганічних каталізаторів5. Ферменти здатні каталізувати всього лише один-єдиний тип реакції.
- 11. Класифікація ферментівЗа типом реакцій, що каталізують, ферменти
- 12. Класифікація ферментів КФ 1: Оксидоредуктази —
- 13. Класифікація ферментів
- 14. Будова ферментуБілокЗазвичай побудований із декількох субодиниць
- 15. Будова ферментуАктивний центр — особлива частина молекули
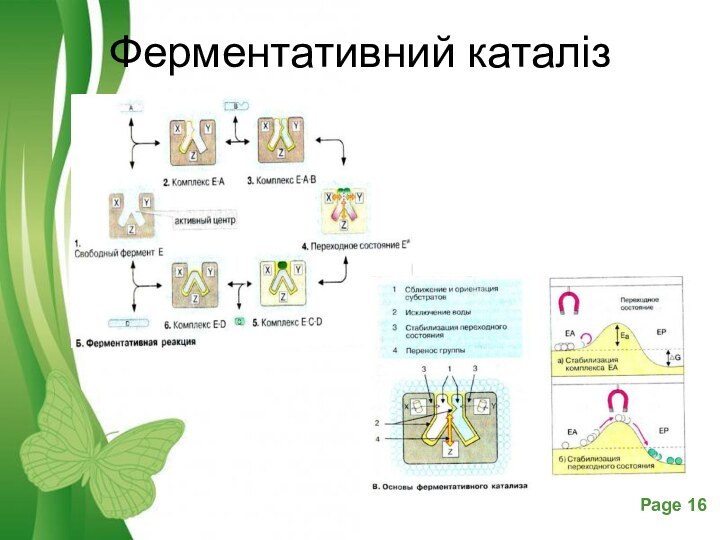
- 16. Ферментативний каталіз
- 17. Кінетика ферментативної реакціїде Vmax — максимальна швидкість реакції,
- 18. Кофактори ферментів небілкова (неамінокислотна) хімічна сполука,
- 19. Кофактори ферментівКофактори зазвичай поділяють на дві великі
- 20. Кофактори ферментів У обміні речовин коферменти найчастіше залучені
- 21. Механізми, які контролюють швидкість метаболічних процесів Абсолютна
- 22. Активатори ферментівРечовини, які підвищують активність ферментів. До
- 23. Активатори ферментівАктивація деяких ферментів може здійснюватися шляхом
- 24. ІнгібіториРечовини, які знижують активність ферментівБувають оборотні і
- 25. ІнгібіториЗа механізмом дії інгібітори ферментів розподіляються на основні типи: конкурентні, неконкурентні,безконкурентні, субстратні або метаболітні, алостеричні.
- 26. Конкурентні інгібіториза будовою подібні до субстрату, вони
- 27. Неконкурентне гальмуванняГальмування, пов'язане із впливом інгібітора на
- 28. Неконкурентне гальмуванняПрикладом необоротного неконкурентного гальмування може бути
- 29. Безконкурентне гальмуванняСпостерігається в тому випадку, коли інгібітор
- 30. Алостерична регуляція активності ферментівДеякі ферменти (регуляторні) крім
- 31. Алостеричні ефекториНегативні ефектори гальмують перетворення субстрату, тобто,
- 32. Скачать презентацию
- 33. Похожие презентации
Ферме́нти або ензи́ми — органічні каталізатори білкової або РНК природи, які утворюються в живих організмах, які здатні прискорювати перебіг хімічних реакцій в організмі.






























Слайд 3
Історична довідка
Термін «фермент» був запропонований у 17 столітті
хіміком ван Гельмонтом для опису механізмів травлення.
У кінці
18 — на початку 19 століття вже було відомо, що м'ясо перетравлюється шлунковим соком, а крохмаль перетворюється на цукор під дією слини. Проте механізм цих явищ був ще невідомий. У 19 столітті Луї Пастер, вивчаючи перетворення вуглеводів в етиловий спирт під дією дріжджів, дійшов до висновку, що цей процес (бродіння) каталізується якоюсь «життєвою силою», що знаходиться в дріжджових клітинах.
Слайд 4
Історична довідка
Понад сто років тому терміни «фермент» і
«ензим» відображали різні погляди Луї Пастера з одного боку
та Марселена Бертло і Юстуса Лібіха з іншого в теоретичній суперечці про природу спиртового бродіння.Власне «ферментами» (від лат. fermentum — «закваска») називали «організовані ферменти» (тобто саме живі мікроорганізми), а термін «ензим» (від грец. ἐν- — «в-» і ζύμη — «дріжджі», «закваска»), запропонований 1876 року В. Кюне для «неорганізованих ферментів», що секретуються клітинами, наприклад, до шлунку (пепсин) або кишечника (трипсин, амілаза).
Два роки по смерті Пастера, 1897 року, Едуард Бюхнер опублікував роботу «Спиртове бродіння без дріжджових клітин», в якій експериментально показав, що екстракт клітин дріжджів здійснює спиртове бродіння так само, як і незруйновані дріжджові клітини.
1907 року за цю роботу він був удостоєний Нобелівської премії.
Слайд 5 Ферменти наявні в усіх живих клітинах і сприяють
перетворенню одних речовин (субстратів) на інші (продукти).
Ферменти виступають
в ролі каталізаторів практично в усіх біохімічних реакціях, що відбуваються в живих організмах — ними каталізується близько 4000 окремих біореакцій
Слайд 6
Спільне між ферментами та неорганічними каталізаторами
Подібно до всіх
каталізаторів, ферменти прискорюють як пряму, так і зворотну реакцію,
знижуючи енергію активації процесу.Хімічна рівновага при цьому не зсувається ні в прямий, ні в зворотний бік.
Слайд 7
Відмінності ферментів і неорганічних каталізаторів
Неорганічні каталізатори за своєю
природою — неорганічні речовини, а ферменти — білки.
Ферменти в
порівнянні з неорганічними каталізаторами володіють специфічністю дії до субстрату і найбільш високою ефективністю
Слайд 8
Порівняння ферментів і неорганічних каталізаторів
3. Ферменти здатні працювати
лише у фізіологічних умовах у обмеженому діапазоні температур (як
правило, 37С). Швидкість дії неорганічних каталізаторів з кожним збільшенням температури на 10 градусів підвищується в 2-4 рази.
Слайд 9
Порівняння ферментів і неорганічних каталізаторів
4. Синтез та каталітична
активність ферментів контролюється на генетичному рівні, та за участю
інших сполук (існують інгібітори та активатори ферментів). Неорганічним катализаторам властива нерегульована робота
Слайд 10
Порівняння ферментів і неорганічних каталізаторів
5. Ферменти здатні каталізувати
всього лише один-єдиний тип реакції.
Слайд 11
Класифікація ферментів
За типом реакцій, що каталізують, ферменти поділяються
на 6 класів згідно з ієрархічною класифікацією ферментів (КФ
або EC — Enzyme Commission code).Класифікацію було запропоновано Міжнародним союзом біохімії і молекулярної біології (International Union of Biochemistry and Molecular Biology).
Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками.
Слайд 12
Класифікація ферментів
КФ 1: Оксидоредуктази — ферменти,
що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа
КФ 2: Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ.КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза.
КФ 4: Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
КФ 5: Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрату.
КФ 6: Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза.
Слайд 15
Будова ферменту
Активний центр — особлива частина молекули ферменту,
що визначає його специфічність і каталітичну активність.
Активний центр безпосередньо
здійснює взаємодію з молекулою субстрату або з тими її частинами, які беруть участь в реакції. Активний центр зазвичай має вигляд маленької «кишені» на поверхні ферменту, яка містить залишки, що відповідають за специфічність до субстрату (заряд, гідрофобність, стеричні перешкоди), що з'єднуються з різними ділянками субстрата, і каталітичні залишки, які часто служать донорами або акцепторами протону, або відповідають за зв'язування кофактору (наприклад PLP, TPP або НАД+).Активний центр — також ділянка зв'язування інгібіторів ферменту.
Слайд 17
Кінетика ферментативної реакції
де Vmax — максимальна швидкість реакції, яка
спостерігається тоді, коли фермент повністю насичений субстратом,
Km — константа
Міхаеліса — концентрація субстрату, при якій швидкість реакції дорівнює половині максимальної. Константа Міхаеліса-Ментен має розмірність моль/л і часто використовується для кількісного вираження спорідненості ферменту до субстрату (чим менша Km, тим більша спорідненість), проте таке її трактування не завжди коректне.
Слайд 18
Кофактори ферментів
небілкова (неамінокислотна) хімічна сполука, органічна або
неорганічна, що зв'язується (щільно або вільно) з ферментами і
потрібна для виконання ним своєї біологічної функції.Вони можуть розглядатися як «допоміжні молекули/іони», які допомагають в біохімічних перетвореннях білка.
Певні речовини, такі як вода і поширені іони, хоча і зв'язуються білками, не вважаються кофакторами, тому що вони усюдисущі і рідко обмежують утворення активної форми білка.
Слайд 19
Кофактори ферментів
Кофактори зазвичай поділяють на дві великі групи:
коферменти і простетичні групи.
Коферменти дуже вільно зв'язуються з
ферментами легко вивільняються в процесі нормального каталітичного циклу. Їхньою головною роллю зазвичай є перенесення хімічних групи між білками. На відміну від них, простетичні групи зв'язуються дуже щільно і формують постійну частину структури білка.
Фермент без зв'язаного кофактору називається апоферментом, а повний активний фермент разом із приєднаним кофактором або кількома кофакторами — голоферментом.
Слайд 20
Кофактори ферментів
У обміні речовин коферменти найчастіше залучені до
реакцій передачі групи, наприклад кофермент A і аденозинтрифосфат (АТФ),
та окислювально-відновлювальних реакцій, наприклад кофермент Q10 і нікотинамідаденіндинуклеотид (НАД+).Коферменти постійно споживаються і переробляються в процесі обміну речовин, одні ферменти зазвичай додають кофермент до ферментів, а інші усувають їх.
Молекули коферментів часто є вітамінами або утворюються з них.
Багато коферментів містять нуклеотиди (часто аденозинмонофосфат) як частину своїх структур, наприклад АТФ і НАД+
Слайд 21
Механізми, які контролюють швидкість метаболічних процесів
Абсолютна кількість присутнього
в клітині ферменту (регулюється швидкістю його синтезу і розпаду)
Явище
так званої компартменталізації - просторове роз'єднання за допомогою мембран ферментів зі своїми субстратами, що дозволяє протікати процесам із протилежною спрямованістю.Частковий протеоліз
Активування чи інгібування ферментів
Слайд 22
Активатори ферментів
Речовини, які підвищують активність ферментів. До активаторів
належать кофактори, іони металів, різноманітні модифікатори, субстрат у певних
концентраціях.
Слайд 23
Активатори ферментів
Активація деяких ферментів може здійснюватися шляхом приєднання
до алостеричного центру ферменту якої-небудь специфічної модифікуючої групи, що
сприяє зміні конформації ферменту і його активного центру
Слайд 24
Інгібітори
Речовини, які знижують активність ферментів
Бувають оборотні і необоротні:
якщо молекула інгібітора викликає стійкі зміни або модифікацію функціональних
груп ферменту, то такий тип гальмування називається необоротним.Оборотні інгібітори взаємодіють із ферментом без утворення ковалентних зв'язків.
Слайд 25
Інгібітори
За механізмом дії інгібітори ферментів розподіляються на основні
типи: конкурентні,
неконкурентні,
безконкурентні,
субстратні або метаболітні,
алостеричні.
Слайд 26
Конкурентні інгібітори
за будовою подібні до субстрату, вони конкурують
із ним за зв'язування з активним центром ферменту. Характерною
рисою конкурентного гальмування є те, що ефективність інгібітора залежить від співвідношення концентрацій субстрату й інгібітора
Слайд 27
Неконкурентне гальмування
Гальмування, пов'язане із впливом інгібітора на каталітичне
перетворення, але не на зв'язування субстрату з ферментом, тому
конкурентних відносин між субстратом і інгібітором немає, і ступінь гальмування залежить тільки від концентрації останнього.Неконкурентний інгібітор або зв'язується безпосередньо з каталітичними групами активного центру ферменту, або, зв'язуючись із ферментом поза активним центром, змінює конформацію активного центру і, таким чином, впливає на структуру каталітичної ділянки, заважаючи взаємодії із нею субстрату.
Слайд 28
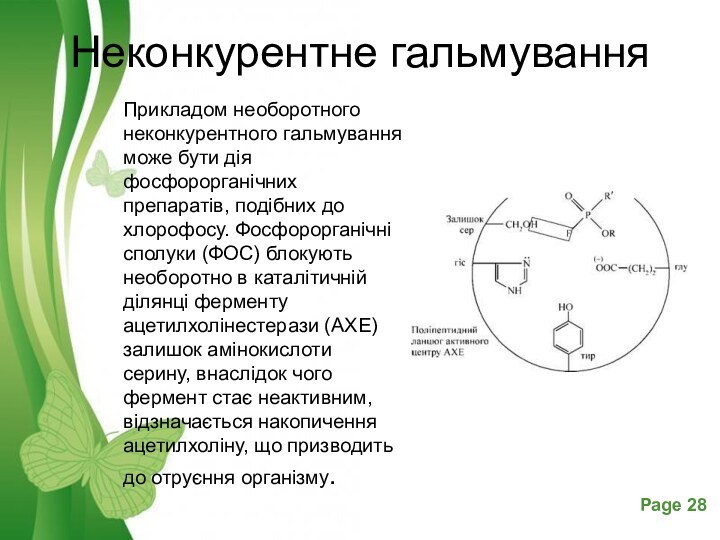
Неконкурентне гальмування
Прикладом необоротного неконкурентного гальмування може бути дія
фосфорорганічних препаратів, подібних до хлорофосу. Фосфорорганічні сполуки (ФОС) блокують
необоротно в каталітичній ділянці ферменту ацетилхолінестерази (АХЕ) залишок амінокислоти серину, внаслідок чого фермент стає неактивним, відзначається накопичення ацетилхоліну, що призводить до отруєння організму.
Слайд 29
Безконкурентне гальмування
Спостерігається в тому випадку, коли інгібітор оборотно
взаємодіє з ферментом тільки після утворення фермент-субстратного комплексу, тобто
безконкурентний інгібітор не поєднується з ферментом у відсутності субстрату. Окрім того, інгібітор полегшує приєднання субстрату, а потім, зв'язуючись, гальмує фермент. Це більш рідкісний вид гальмування.
Слайд 30
Алостерична регуляція активності ферментів
Деякі ферменти (регуляторні) крім активного
центру мають алостеричний центр для зв'язування алостеричних ефекторів (модифікаторів),
які після взаємодії з алостеричним центром роблять фермент або активним, або неактивнимАлостерична регуляція характерна, головним чином, для ферментів, які мають четвертинну структуру