- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Энергетика химических реакций
Содержание
- 2. Термодинамикасистема- открытая- закрытая- изолированная
- 3. Тепловая энергия Q, [Дж]Параметры состояния: P, T, V, состав системы
- 4. Функции состояния:Внутренняя энергия U, Энтальпия H, Энтропия S, Энергия Гиббса (изобарно-изотермический потенциал) G.
- 5. Первый закон термодинамикиQ = ΔU + AΔU
- 6. Изохорный процесс:V=const, ΔV = 0,
- 7. H = U + рV, Отсюда:Qp =
- 8. H2(г) + 1/2О2(г) → H2O(ж); ΔrH
- 9. ΔfH°298(O2) = 0, ΔfH°298(C(графит)) = 0, Однако: ΔfH°298(O3) = 142,3 кДж/моль, ΔfH°298(C(алмаз)) = 1,828 кДж/моль
- 10. Закон Лавуазье-Лапласа1/2H2 (г) + 1/2Сl2(г) → HCl(г);
- 11. C + ½O2 = COCO + ½O2 = CO2C + O2 = CO2Закон Гесса
- 12. Следствие из закона Гесса:ΔH = Для реакции
- 13. Пример: Вычислить тепловой эффект реакции горения бензола
- 14. Энтропия, S [Дж/(моль⋅К)]Процессы, для которых ΔS >
- 15. Процессы, для которых ΔS < 0:1) сжатие
- 16. NH4NO2(к) = N2О(г) + 2H2О(г) V1 V2V1
- 17. Энергия Гиббса, ΔG, [кДж/моль] ΔG = ΔН – ТΔS
- 18. ΔG < 0 – процесс термодинамически возможен
- 19. Возможность протекания реакцииРеакция экзотермическаяΔН < 0,
- 20. Реакция эндотермическаяΔН > 0, ΔS <
- 22. NH3(г) + HCl(г) = NH4Сl(к)
- 23. Из з-на Гесса энтальпия реакции:ΔrН° = ΔН°(NH4Сl(к))
- 24. Скачать презентацию
- 25. Похожие презентации
Термодинамикасистема- открытая- закрытая- изолированная


![Энергетика химических реакций Тепловая энергия Q, [Дж]Параметры состояния: P, T, V, состав системы](/img/tmb/15/1429854/95596d7e403c5a8e3756c0b0df4eb1de-720x.jpg)





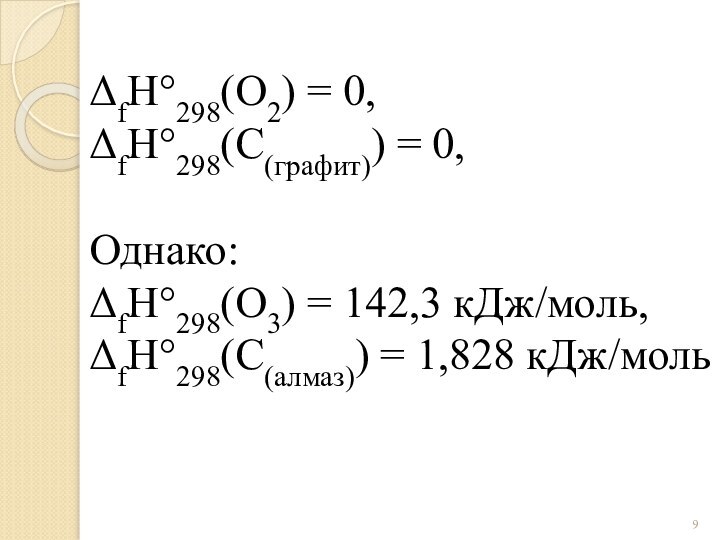




![Энергетика химических реакций Энтропия, S [Дж/(моль⋅К)]Процессы, для которых ΔS > 0:1) расширение газов;2) Sтв <](/img/tmb/15/1429854/e13075ea6d824da914ff4f390345c7d0-720x.jpg)

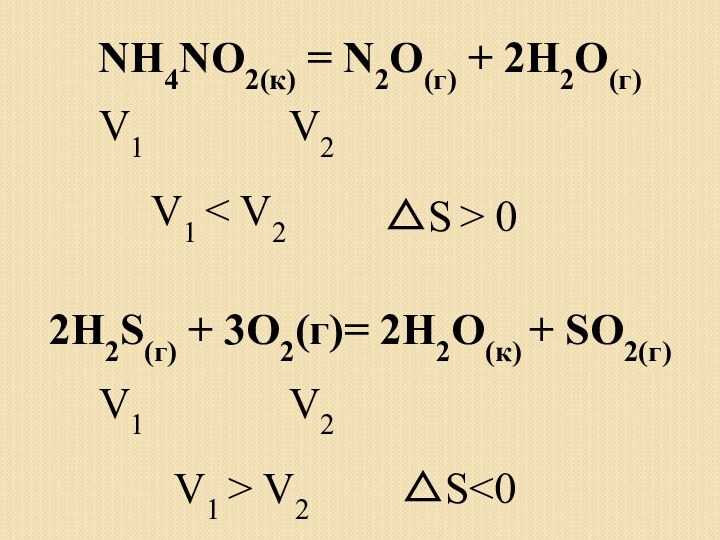
![Энергетика химических реакций Энергия Гиббса, ΔG, [кДж/моль] ΔG = ΔН – ТΔS](/img/tmb/15/1429854/74df814e7b8cab053d02fbafdf70ff64-720x.jpg)





Слайд 4
Функции состояния:
Внутренняя энергия U,
Энтальпия H,
Энтропия S,
Энергия Гиббса (изобарно-изотермический потенциал) G.
Слайд 5
Первый закон термодинамики
Q = ΔU + A
ΔU =
U2 – U1,
U2 и U1 – внутренняя энергия
системы в состоянии 2 и 1 соответственно.A = p(V2–V1) = p△V
Слайд 6
Изохорный процесс:
V=const, ΔV = 0, А
= 0, тогда
QV = ΔU
Изобарный процесс:
Р=const
ΔV = V2 –
V1, А = рΔV
Qp = ΔU + рΔV
Qp = (U2 + рV2) – (U1 + рV1)
Слайд 7
H = U + рV,
Отсюда:
Qp = Н2
– Н1 = ΔН
ΔH > 0 – эндотермический процесс
ΔH
< 0 – экзотермический процесс
Энтальпия, ΔH [кДж/моль]
Слайд 8
H2(г) + 1/2О2(г) → H2O(ж);
ΔrH
= –285,84
кДж
при 25°С и 101 кПа
ΔH°обр или ΔfH°298 ,
[кДж/моль]ΔrН°< 0, реакция экзотермическая
Слайд 9
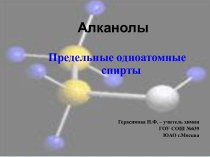
ΔfH°298(O2) = 0,
ΔfH°298(C(графит)) = 0,
Однако:
ΔfH°298(O3)
= 142,3 кДж/моль, ΔfH°298(C(алмаз)) = 1,828 кДж/моль
Слайд 10
Закон Лавуазье-Лапласа
1/2H2 (г) + 1/2Сl2(г) → HCl(г);
ΔrH°298(HCl)
= –92 кДж
HCl(г) → 1/2H2 (г) + 1/2Сl2(г);
ΔrH°298
= +92 кДж
Слайд 12
Следствие из закона Гесса:
ΔH =
Для реакции в
общем виде:
аА + bB → cC + dD
ΔH
= [cΔHобр(C) + dΔHобр(D)] – – [aΔHобр(A) + bΔHобр(B)]
Слайд 13 Пример: Вычислить тепловой эффект реакции горения бензола по
стандартным энтальпиям образования
С6Н6(ж) + 7/2О2(г) = 6СО2(г) + 3Н2О(ж)ΔfH°298 40,6 0 – 394,7 – 286
Воспользуемся следствием из закона Гесса:
ΔrH° = 6ΔH°(СО2(г)) + 3ΔH°( Н2О(ж)) – ΔH°( С6Н6(ж)),
ΔrH° = 6(– 394,7) +3 (– 286) – (+ 40,6) = – 3186,8 кДж.
Слайд 14
Энтропия, S [Дж/(моль⋅К)]
Процессы, для которых ΔS > 0:
1)
расширение газов;
2) Sтв < Sжид < Sгаз
SН2О(пар) = 183
Дж/(моль⋅К)SН2О(жидк.) = 69 Дж/(моль⋅К)
SН2О(лед) = 43,89 Дж/(моль⋅К)
3) растворение кристаллических веществ.
SCo(алмаз) = 2,38 Дж/моль⋅К
SCo(графит) = 5,74 Дж/моль⋅К
Слайд 15
Процессы, для которых ΔS < 0:
1) сжатие газов;
2)
конденсация и кристаллизация веществ.
S
=
Рассчитывается по следствию из закона
Гесса:
Слайд 16
NH4NO2(к) = N2О(г) + 2H2О(г)
V1 V2
V1
V2
△S > 0
2H2S(г) + 3O2(г)= 2H2О(к) +
SО2(г) V1 V2
V1 > V2
△S<0
Слайд 18 ΔG < 0 – процесс термодинамически возможен (реакция
идет самопроизвольно);
ΔG > 0 – процесс термодинамически невозможен (реакция
не идет);ΔG = 0 – система находится в состоянии химического равновесия.
Слайд 19
Возможность протекания реакции
Реакция экзотермическая
ΔН < 0, ΔS
> 0,
ΔН < 0, ΔS < 0,
ΔG
= ΔН – ТΔSто всегда ΔG < 0, т.е. реакция протекает при всех t.
то реакция протекает при низких t (т.е. должно выполняться условие │ΔH│>│TΔS│) (ΔG < 0).
Слайд 20
Реакция эндотермическая
ΔН > 0, ΔS < 0,
ΔН > 0, ΔS > 0,
ΔG = ΔН
– ТΔSто всегда ΔG > 0 , т.е. реакция не протекает.
то реакция протекает при высоких t (т.е. должно выполняться условие │ΔH│<│TΔS│) (ΔG < 0).
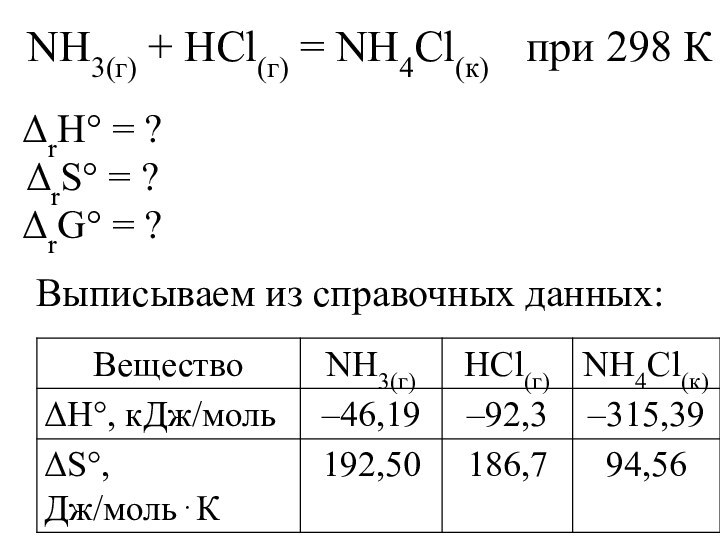
Слайд 22 NH3(г) + HCl(г) = NH4Сl(к) при
298 К
Выписываем из справочных данных:
ΔrН° = ?
ΔrS° = ?
ΔrG°
= ?
Слайд 23
Из з-на Гесса энтальпия реакции:
ΔrН° = ΔН°(NH4Сl(к)) –
ΔН°(NH3(г)) – ΔН°(HCl(г))
= –315,39 – (–46,19 – 92,3)
= –176,9 кДж.Изменение энтропии реакции:
ΔrS° = S°(NH4Сl(к)) – S°(NH3(г)) – S°(HCl(г)) =
= 94,56 – 192,50 – 186,70 = –284,64Дж/моль⋅К.
Используем ур-е Гиббса:
ΔrG° = ΔrН° – ТΔrS°
ΔrG° = – 176,9 + 284,64⋅10–3⋅303 = –90,55 кДж.
ΔrG°< 0, реакция идет