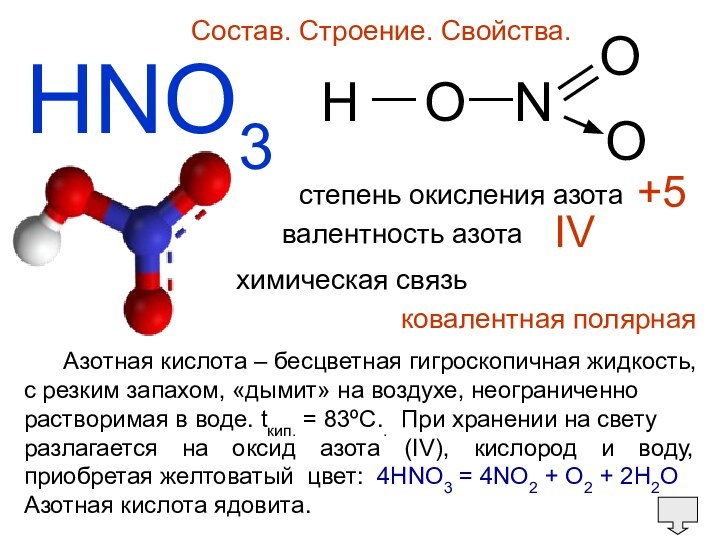
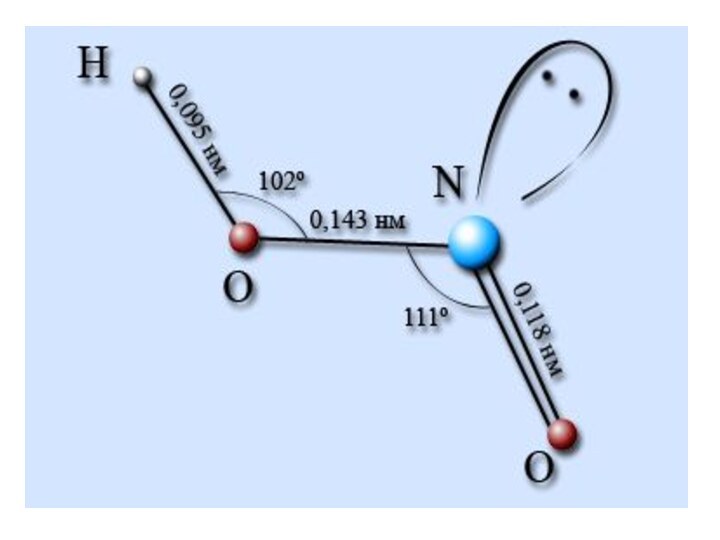
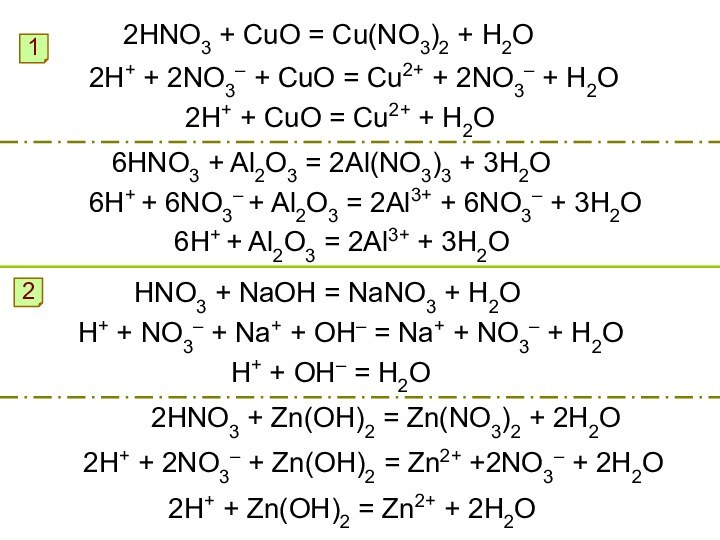
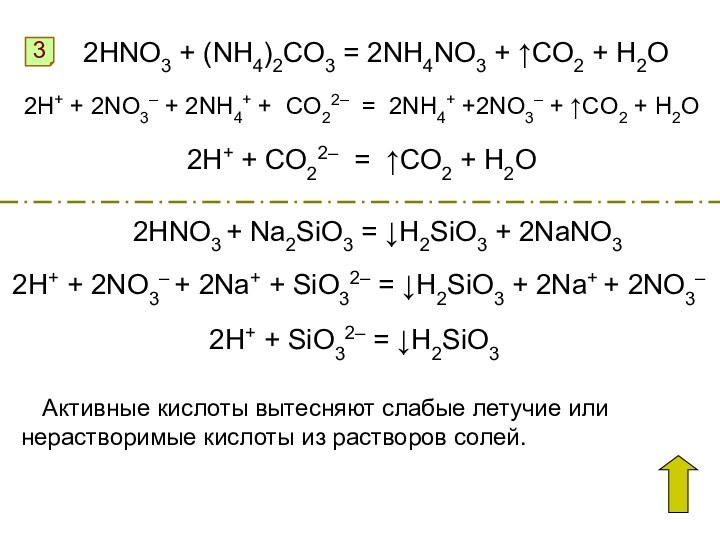
Окисляет неметаллы до соответствующих
кислот.
Концентрированная (более 60%) азотная кислота восстанавливается до NO2 , а если концентрация кислоты (15 – 20%), то до NO.
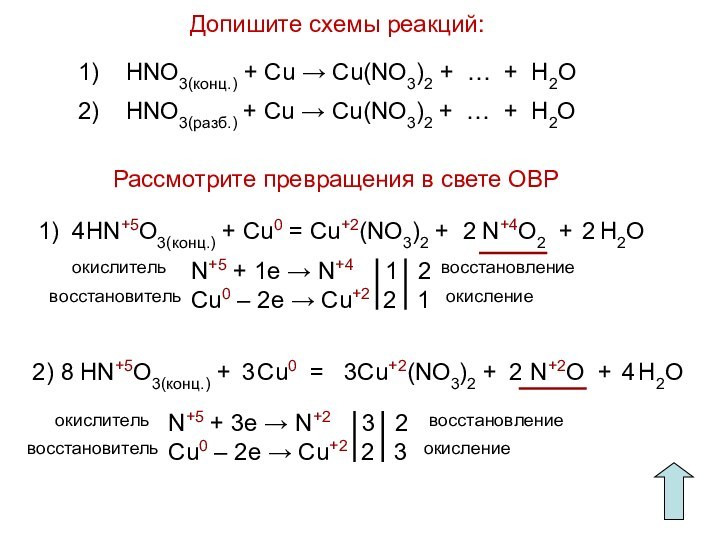
HNO3 + С → СO2 + H2O + NO2
N+5 + 1e → N+4 1 4
С0 – 4e → С+4 4 1
4
4
2
HNO3 + P → H3PO4 + NO2 + H2O
N+5 + 1e → N+4 1 5
P0 – 5e → P+5 5 1
5
2
5
HNO3 + P + H2O → H3PO4 + NO
N+5 + 3e → N+2 3 5
P0 – 5e → P+5 5 3
3
5
3
5
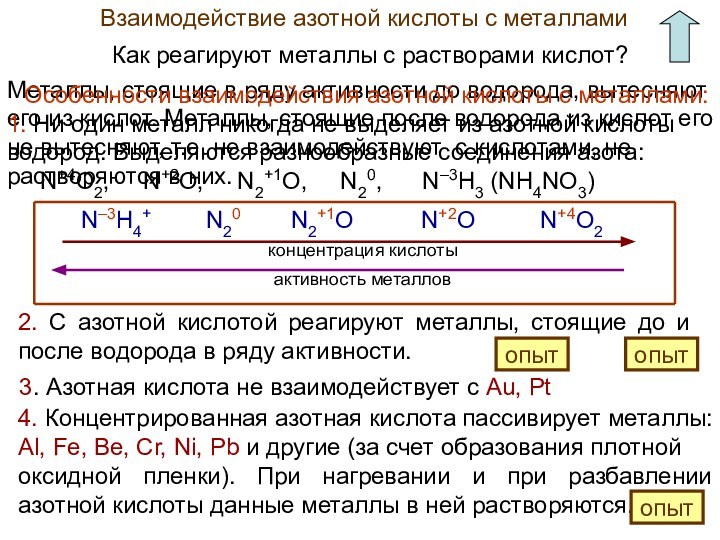
Азотная кислота как сильный окислитель
Расставьте в схемах коэффициенты методом электронного баланса.
HNO3 (за счет N+5) – окислитель, пр. восстановления
C – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
опыт
опыт