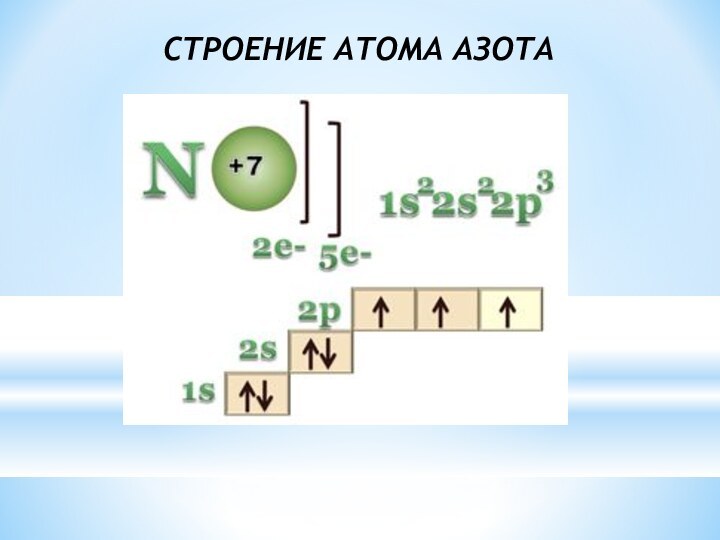
Слайд 3
Распростаненность азота
Азот, в форме двухатомных молекул N2
составляет большую часть атмосферы, где его содержание составляет 75,6 %
(по массе) или 78,084 % (по объёму).
Содержится азота в земной коре в верхней части мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Содержится азота в гидросфере в виде соединений.
Слайд 4
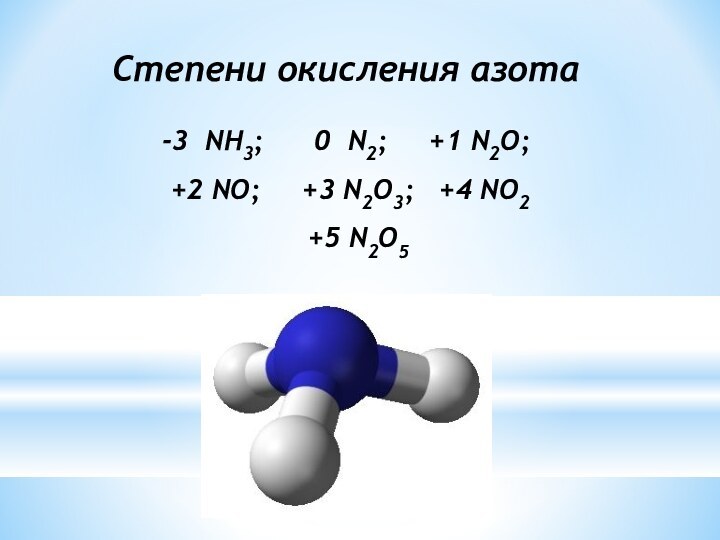
Степени окисления азота
-3 NH3;
0 N2; +1 N2O;
+2 NO; +3 N2O3; +4 NO2
+5 N2O5
Слайд 5
Азот – простое вещество.
Азот – это газ, без
цвета, запаха, вкуса.
Строение молекулы.
Молекула азота образована ковалентной неполярной связью
Слайд 6
Химические свойства азота
В химическом отношении азот довольно инертный
газ из-за прочной ковалентной связи.
1. Взаимодействие с металлами. Свободный
азот реагирует в обычных условиях только с литием, образуя нитрид:
6Li + N2 = 2Li3N
2. Взаимодействие с водородом. При взаимодействии азота с водородом при нагревании, повышенном давлении и присутствии катализатора образуется аммиак:
N2 + 3H2 = 2NH3
3. Взаимодействие с кислородом (при высокой температуре)
N2 + O2 = 2NO
Слайд 7
Получение азота
В лабораториях его можно получать
1. По
реакции разложения нитрита аммония:
NH4NO2
→ N2↑ + 2H2O
2. Нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе).
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O
3. Пропускание аммиака над оксидом меди (II) при температуре ~700°С:
2NH3 + 3CuO → N2↑ + 3H2O + 3Cu
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха.
Слайд 8
Аммиак
Физические свойства
Аммиа́к — NH3, нитрид водорода, при нормальных условиях —
бесцветный газ с резким характерным запахом (запах нашатырного спирта),
почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Слайд 9
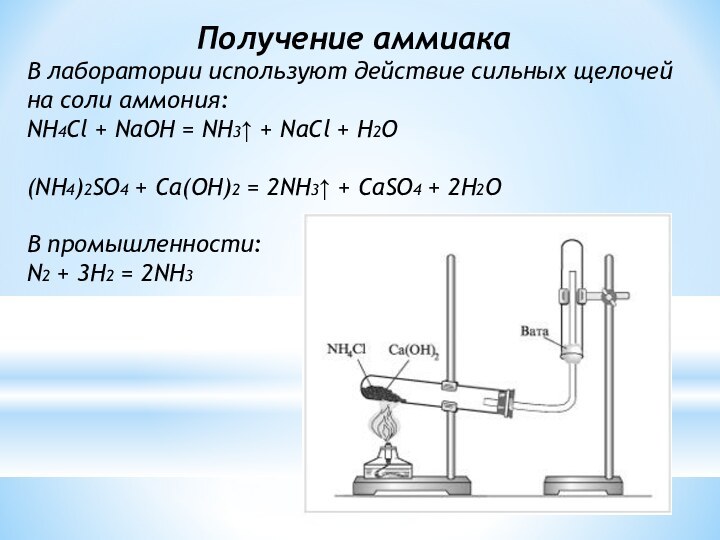
Получение аммиака
В лаборатории используют действие сильных щелочей на
соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl +
H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
В промышленности:
N2 + 3H2 = 2NH3
Слайд 10
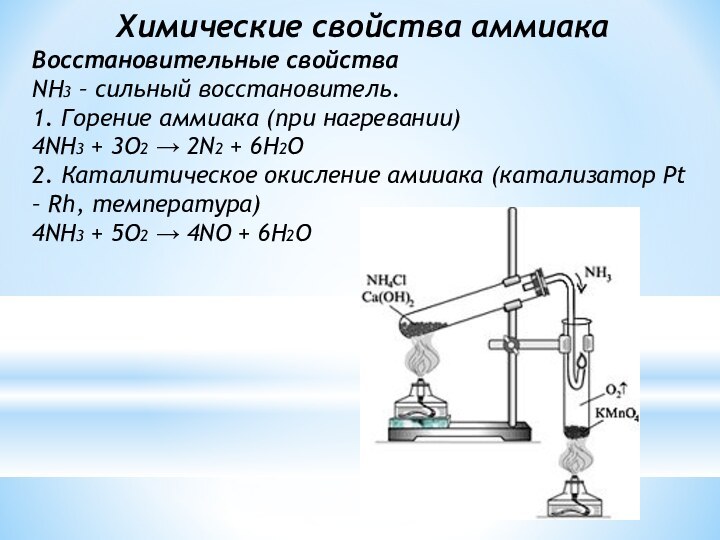
Химические свойства аммиака
Восстановительные свойства
NH3 – сильный восстановитель.
1. Горение
аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H2О
2.
Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Слайд 11
Образование связи по донорно-акцепторному механизму
Катион аммония получается в
результате того, что атом азота имеет свободную (неподеленную) электронную
пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды:
Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным.
Слайд 12
Взаимодействие с водой и кислотами
NH3 + Н2О
NН4 ОН
NH3 + HCl = NH4Cl
2NH3 + H2SO4
= (NH4)2SO4
Слайд 13
Соли аммония
1. Вступают в обменную реакцию с кислотами
и солями:
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
2. Взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
3. Разлагаются при нагревании
NH4Cl → NH3↑ + HCl