- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему НА ТЕМУ БЕЛКИ
Содержание
- 4. Гидролизом аспарагина можно получить аспарагиновую кислоту.
- 5. Глутаминовая кислота способна взаимодействовать с аммиаком, превращаясь в амид – глутамин.
- 7. Это последовательность расположения аминокислотных остатков в полипептидной
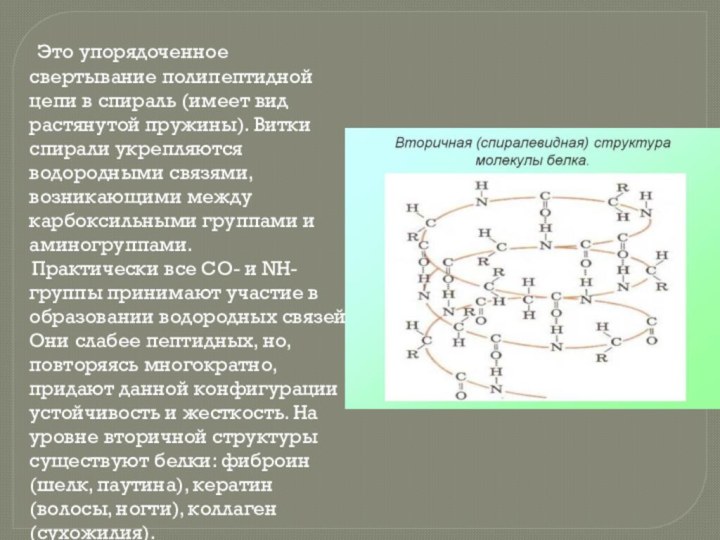
- 8. Это упорядоченное свертывание полипептидной
- 9. Укладка полипептидных цепей в глобулы, возникающая в
- 10. Это одна из самых сложных глобул, которую
- 11. Денатурация – осаждение (свертывание) белков при нагревании,
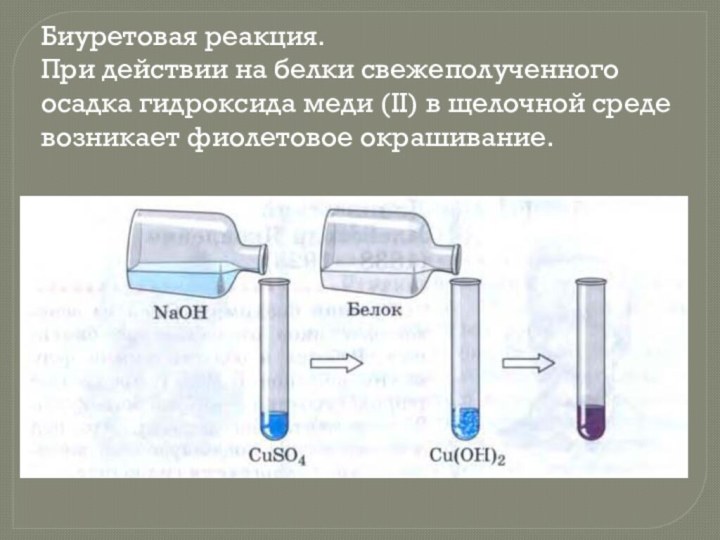
- 13. Биуретовая реакция. При действии на белки
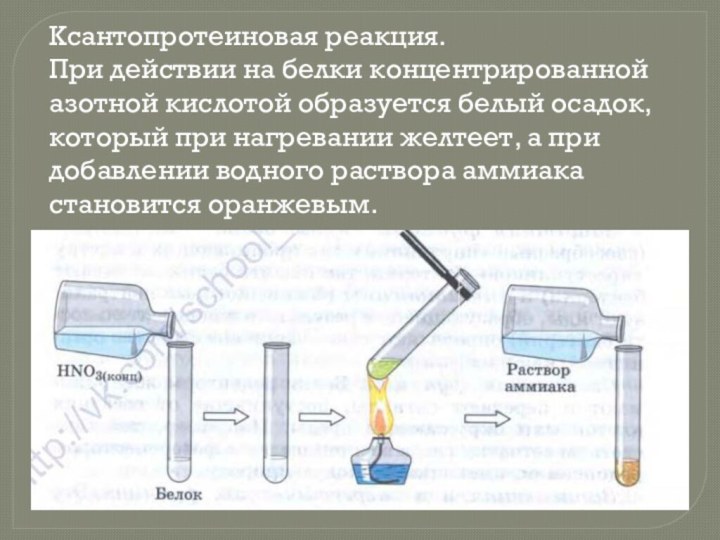
- 14. Ксантопротеиновая реакция. При действии на белки
- 15. Скачать презентацию
- 16. Похожие презентации
Гидролизом аспарагина можно получить аспарагиновую кислоту.





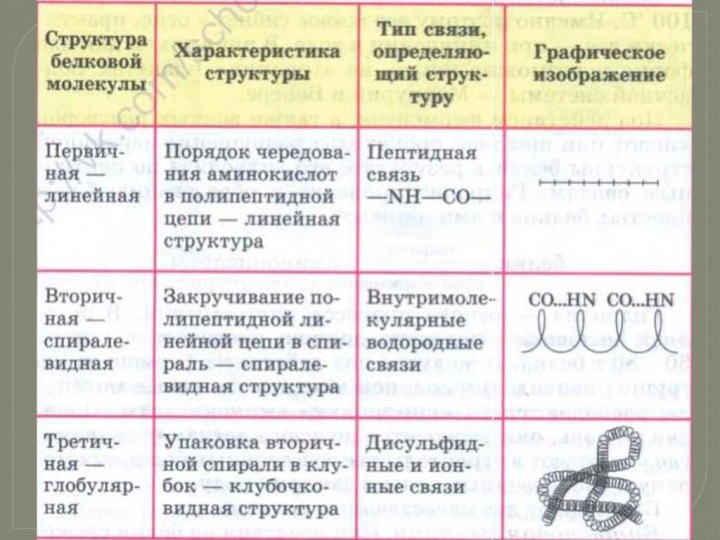
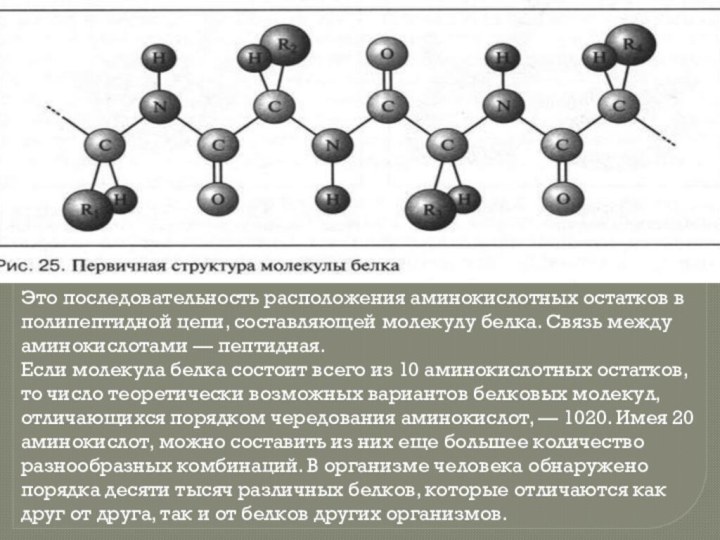





Слайд 7 Это последовательность расположения аминокислотных остатков в полипептидной цепи,
составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула
белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.Слайд 8 Это упорядоченное свертывание полипептидной цепи
в спираль (имеет вид растянутой пружины). Витки спирали укрепляются
водородными связями, возникающими между карбоксильными группами и аминогруппами.Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Слайд 9 Укладка полипептидных цепей в глобулы, возникающая в результате
возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных
взаимодействий между радикалами аминокислотных остатков.Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина.
На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Третичная структура
Слайд 10 Это одна из самых сложных глобул, которую образуют
белки. Строение и функции белков подобного плана очень многогранны
и специфичны.Это несколько (в некоторых случаях десятки) крупных и мелких полипептидных цепей, которые формируются независимо друг от друга. Но затем за счет тех же взаимодействий, что мы рассматривали для третичной структуры, все эти пептиды скручиваются и переплетаются между собой. Таким образом получаются сложные конформационные глобулы, которые могут содержать и атомы металлов, и липидные группировки, и углеводные. Примеры таких белков: ДНК-полимераза, белковая оболочка табачного вируса, гемоглобин и другие.
Четвертичная структура
Слайд 11 Денатурация – осаждение (свертывание) белков при нагревании, под
действием сильных кислот или оснований, солей тяжелых металлов или
других реагентов. Изменение во вторичной и третичной структуре белка.
Первичная структура сохраняется.
Большинство белков сворачивается при температуре до 100°С.