- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Химические свойства металлов (9 класс)
Содержание
- 2. Тема урока «Химические свойства металлов»В химических
- 3. В химических реакциях металлы проявляют только восстановительные
- 4. Цель урока: выявить возможные химические реакции,
- 6. При взаимодействии металлов с кислородом образуются оксиды
- 8. Металлы взаимодействуют с водой2Na + 2H2O = 2NaOH + H2↑.
- 9. Металлы взаимодействуют с водойЛабораторный опыт № 2
- 11. Лабораторный опыт № 4 «Взаимодействие меди с
- 14. Задания группам Какие металлы и при каких
- 15. 1-ая группа Химические свойства металловВзаимодействие с кислородомLi-
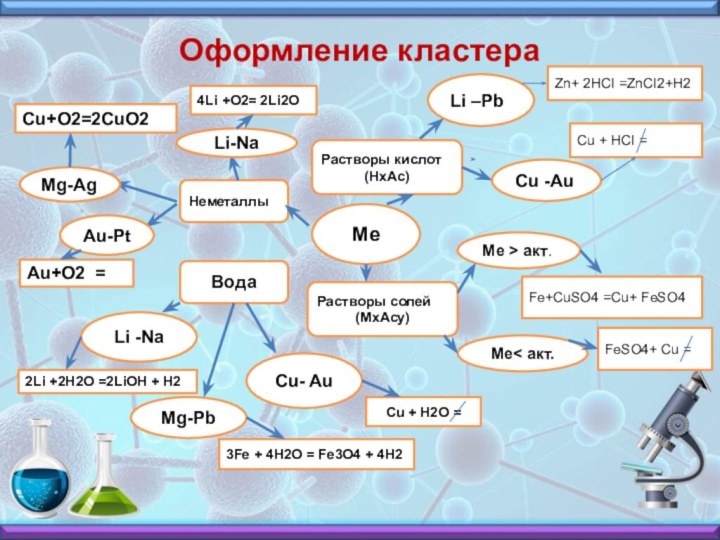
- 19. Оформление кластераМеНеметаллыРастворы кислот(HxAc)Растворы cолей(МxAcу)ВодаLi –PbCu -AuZn+ 2HCI
- 20. Заполните таблицу Химические свойства металлов
- 21. Рефлексия «Я узнал(а) много нового»;
- 22. Ответы к тесту1 – в 2
- 23. Скачать презентацию
- 24. Похожие презентации


















Слайд 2
Тема урока
«Химические свойства металлов»
В химических реакциях металлы
могут быть только восстановителями. Почему?
по активности? Обратите внимание на ряд активности металлов.Слайд 3 В химических реакциях металлы проявляют только восстановительные свойства.
А какие вещества выступают при этом окислителями?
Предположите возможные химические
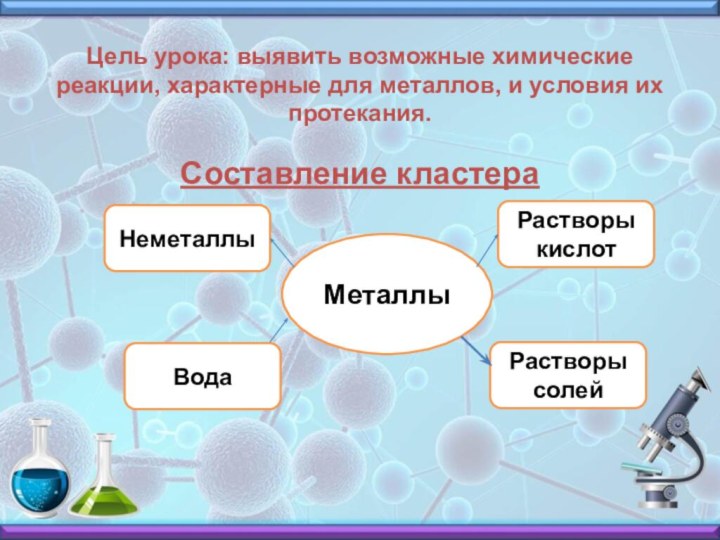
свойства металлов. С какими веществами они могут взаимодействовать?Слайд 4 Цель урока: выявить возможные химические реакции, характерные для
металлов, и условия их протекания.
Составление кластера
Металлы
Неметаллы
Растворы кислот
Вода
Растворы солей
Слайд 5
Предположение
1Металлы взаимодействуют с кислородом
1. Демонстрация горения магния
2. Опыт 1. Горение меди: зажгите спиртовку, закрепите медную проволоку в держателе и нагрейте ее. Что наблюдаете? Объясните.
Какие вещества образуются при взаимодействии металлов с кислородом?
Запишите уравнения химических реакций магния и меди с кислородом.
Определите значение таких реакций. Вред или пользу они приносят?
Слайд 6 При взаимодействии металлов с кислородом образуются оксиды с
общей формулой МxOy
2Mg + O2 = 2MgO (оксид магния),
2Cu
+ O2 = 2CuO(оксид меди(II)).Слайд 7
Предположение 2
Металлы взаимодействуют с водой
Демонстрационный эксперимент: «Взаимодействие
натрия с водой».Что наблюдаете?
Почему изменился цвет индикатора?
Запишите уравнение химической реакции натрия с водой.
Слайд 9
Металлы взаимодействуют с водой
Лабораторный опыт № 2 «Отношение
меди к воде при обычных условиях и нагревании».
Налейте в
пробирку воды и опустите туда кусочек медной проволоки. Что наблюдаете? Нагрейте с помощью спиртовки. Есть ли изменения? Объясните.Слайд 10
Предположение 3
Металлы взаимодействуют с кислотами
Лабораторный опыт №
3 «Взаимодействие цинка с раствором соляной кислоты».В пробирку поместите кусочек цинка, прилейте раствор соляной кислоты (HCl). Что наблюдаете? Объясните.
Слайд 11 Лабораторный опыт № 4 «Взаимодействие меди с раствором
соляной кислоты».
В пробирку поместите кусочек медной проволоки, прилейте раствор
соляной кислоты (HCl). Что наблюдаете? Объясните.Запишите уравнения возможных химических реакций:
Zn + 2HCl = ZnCl2 + H2↑,
Cu + HCl ≠ реакция не идёт.
Слайд 12
Предположение 4 Металлы взаимодействуют с растворами солей
Лабораторный опыт № 5 «Взаимодействие железа с раствором сульфата меди(II)»
Налейте в пробирку раствор сульфата меди(II), опустите кусочек железа. Что наблюдаете? Объясните.
Лабораторный опыт № 6 «Взаимодействие меди с раствором сульфата железа(II)»
Налейте в пробирку раствор сульфата железа(II), опустите кусочек меди. Что наблюдаете? Объясните.
Слайд 13
Предположение 4
Запишите уравнение возможной химической реакции:
Fe + CuSO4 = FeSO4 + Cu ;
Cu + FeSO4 ≠ реакция не идёт.
M
Соли
?
Слайд 14
Задания группам
Какие металлы и при каких условиях
реагируют с перечисленными классами веществ?
Попробуйте выявить зависимость между
химическими свойствами металлов и их положением в электрохимическом ряду напряжений.Внесите поправки в кластер «Химические свойства металлов».
Слайд 15
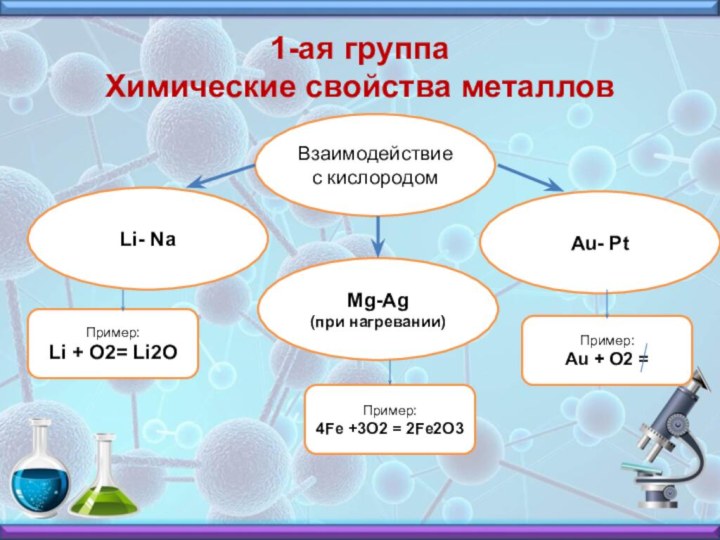
1-ая группа
Химические свойства металлов
Взаимодействие с кислородом
Li- Na
Mg-Ag
(при нагревании)
Au- Pt
Пример:
Li + O2= Li2O
Пример:
4Fe +3O2 = 2Fe2O3
Пример:
Au + O2 =
Слайд 16
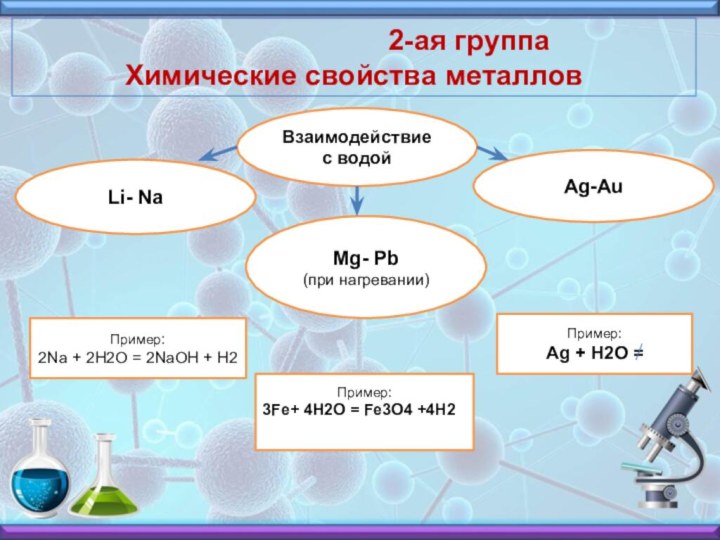
2-ая группа
Химические свойства металловВзаимодействие с водой
Li- Na
Ag-Au
Mg- Pb (при нагревании)
Пример:
2Na + 2H2O = 2NaOH + H2
Пример:
3Fe+ 4H2O = Fe3O4 +4H2
Пример:
Ag + H2O =
Слайд 17
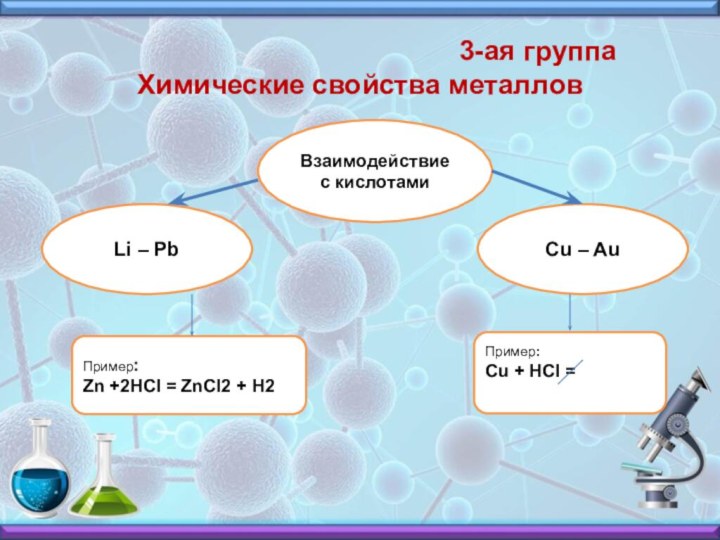
3-ая группа Химические свойства металлов
Взаимодействие с кислотами
Li – Pb
Cu – Au
Пример:
Zn +2HCI = ZnCI2 + H2
Пример:
Cu + HCI =
Слайд 18
4-ая группа Химические свойства металлов
Взаимодействие с растворами солей
Более активный металл вытесняет менее активный
Менее активный металл не вытесняет более активный
Пример: CuSO4 + Fe = FeSO4+Cu
Пример:
FeSO4 + Cu =
Слайд 19
Оформление кластера
Ме
Неметаллы
Растворы кислот
(HxAc)
Растворы cолей
(МxAcу)
Вода
Li –Pb
Cu -Au
Zn+ 2HCI =ZnCI2+H2
Cu
+ HCI =
Ме > акт.
Ме< акт.
Fe+CuSO4 =Cu+ FeSO4
FeSO4+ Cu
=Mg-Pb
Cu- Au
Li -Na
Cu + H2O =
3Fe + 4H2O = Fe3O4 + 4H2
2Li +2H2O =2LiOH + H2
4Li +O2= 2Li2O
Cu+O2=2CuO2
Au+O2 =
Au-Pt
Mg-Ag
Li-Na
Слайд 21
Рефлексия
«Я узнал(а) много нового»;
«Мне это пригодится в жизни»;
«На
уроке было над чем подумать»;«На все вопросы, возникающие в ходе урока, я получил(а) ответы»;
«На уроке я работал(а) добросовестно и цели урока достиг(ла)».
Учитель просит поднять руки тех, кто поставил пять плюсов на поставленные вопросы, затем тех, у кого четыре и три плюса и т.д.





























