внутри которого есть 30 протонов и 35 нейтронов, а
вокруг, по четырем орбитам движутся 30 электронов.Справа схематическое строение атома цинка.
Электронное строение атома цинка
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть
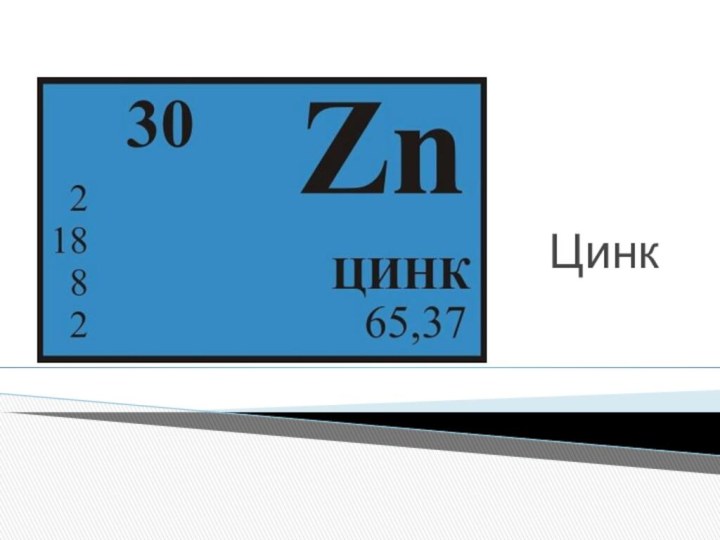







Электронное строение атома цинка
Получение цинка
Физические свойства цинка
Химические свойства цинка