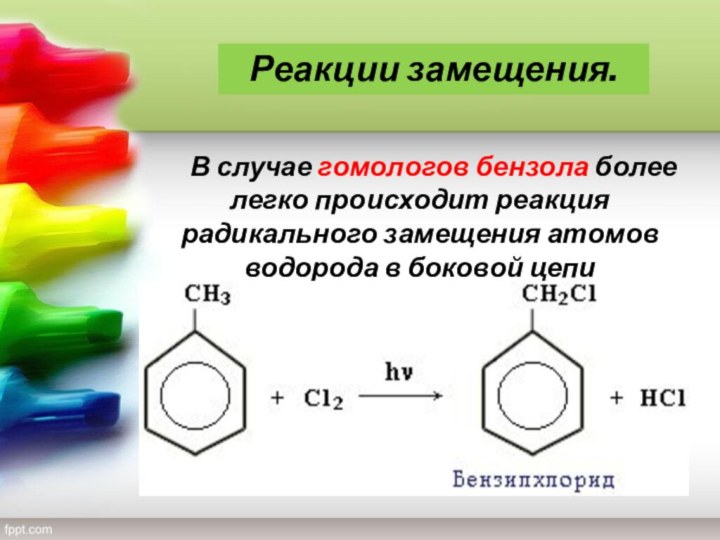
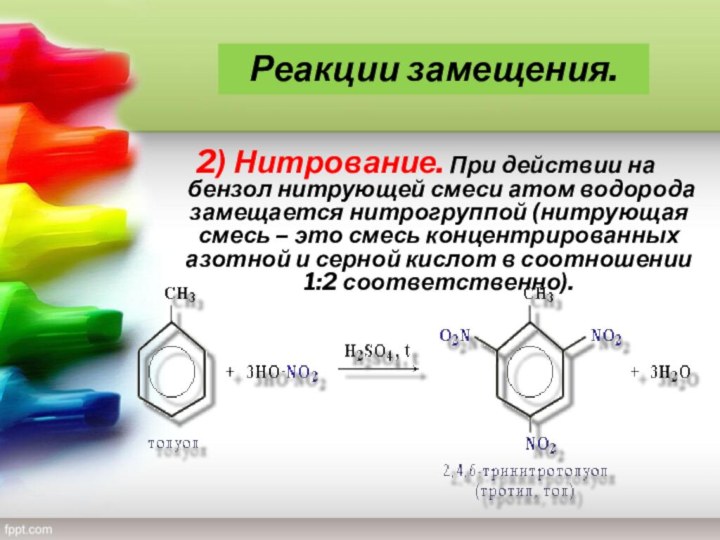
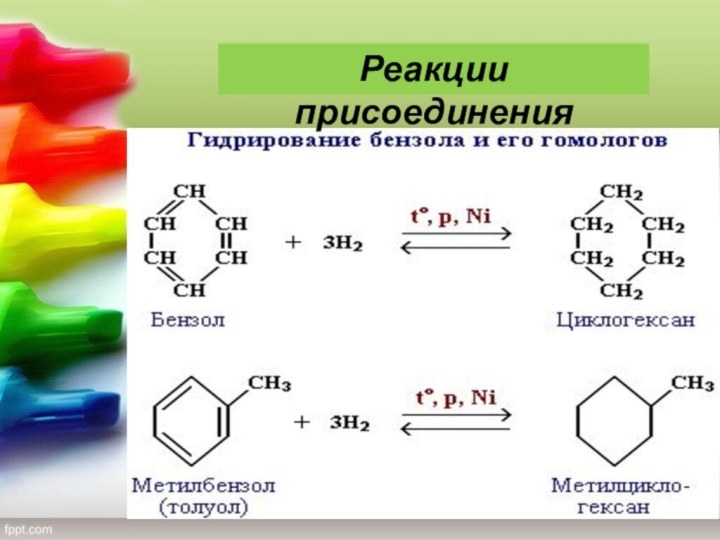
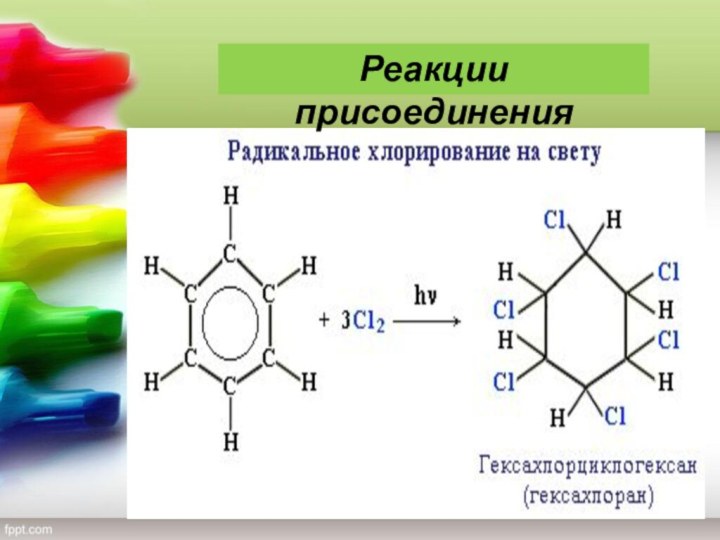
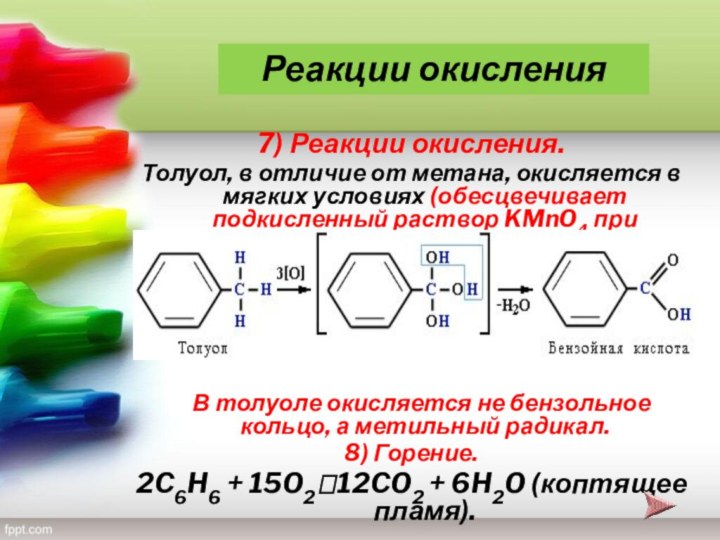
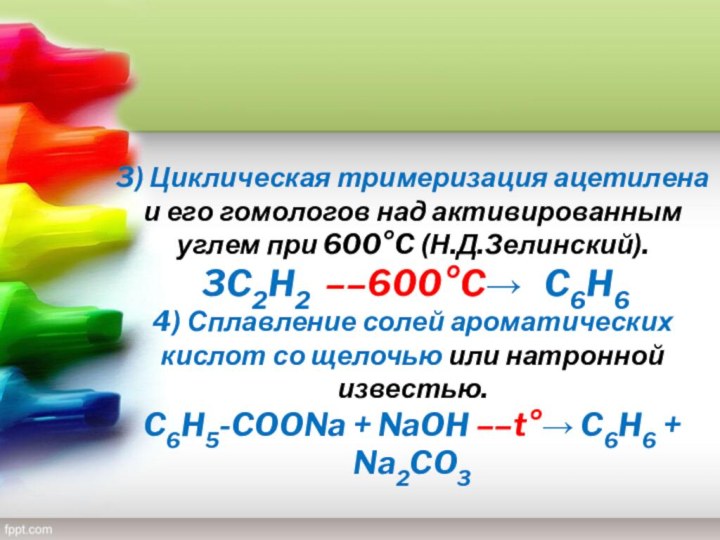
— благовоние), класс органических циклических соединений, все атомы которых
участвуют в образовании единой сопряжённой системы; p-электроны такой системы образуют устойчивую, т. е. замкнутую, электронную оболочку.Название «Ароматические соединения» закрепилось вследствие того, что первые открытые и изученные представители этого класса веществ обладали приятным запахом.
Общая формула ароматических углеводородов
CnH2n-6. (n не менее 6)
СЛОВАРЬ