Зависимость скорости реакции от концентрации реагирующих веществ и продуктов
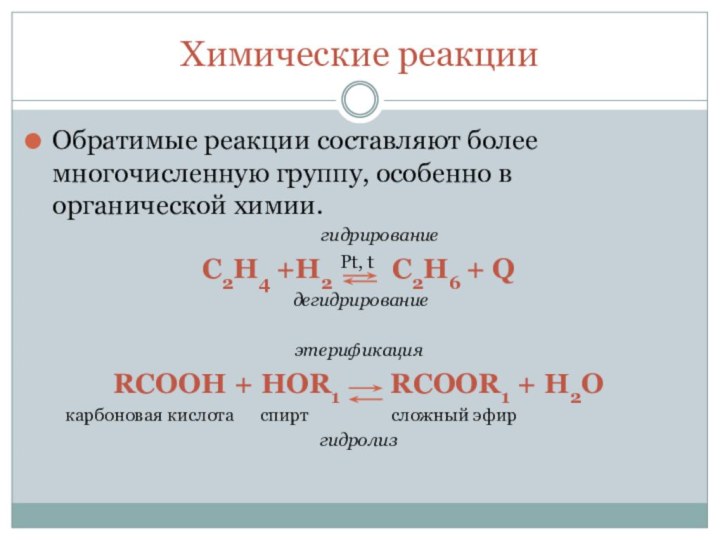
реакции3. Химическое равновесие
4. Принцип Ле-Шателье
5. Факторы, влияющие на смещение химического равновесия
6. Закрепление материала
7. Домашнее задание
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










-