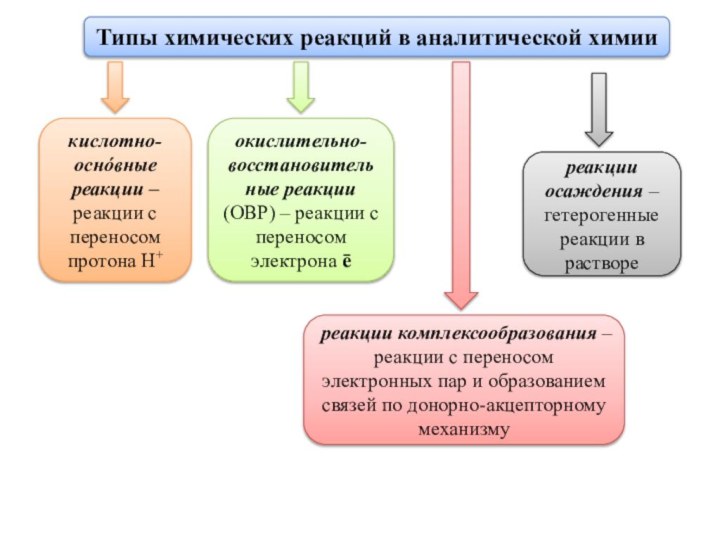
реакции с переносом протона Н+
окислительно-восстановительные реакции (ОВР) – реакции
с переносом электрона ēреакции комплексообразования – реакции с переносом электронных пар и образованием связей по донорно-акцепторному механизму
реакции осаждения – гетерогенные реакции в растворе