Слайд 2
Введение:
Пятая группа Периодической системы включает два типических элемента
азот и фосфор – и подгруппы мышьяка и ванадия.
Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество.
Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили его способность светиться в темноте).
Слайд 3
История открытия фосфора
По иронии судьбы
фосфор открывался несколько раз. Причем всякий раз получали его
из … мочи. Есть упоминания о том, что арабский алхимик
Альхильд Бехиль (XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью и углем. Однако датой открытия фосфора считается 1669 год.
Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать «первичную материю», считавшейся основой философского камня.
Слайд 4
Хеннинг Бранд- Гамбургский алхимик-любитель
Слайд 5
Несколько лет «рецепт приготовления» фосфора хранился в
строжайшем секрете и был известен лишь нескольким алхимикам. В
третий раз фосфор открыл Р.Бойль в 1680 году.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO), поваренной солью (NaCl), поташом (K2CO3) и углем (C). Лишь к 1777 году К.В.Шееле заработал способ получения фосфора из рога и костей животных.
Слайд 6
Роберт Бойль — физик, химик и богослов, седьмой сын Ричарда Бойля, графа
Коркского, вельможи времён Елизаветы Английской
Слайд 7
Природные соединения и получение фосфора

По распространенности в земной коре фосфор опережает азот, серу
и хлор. В отличие от азота фосфор, из-за большой химической активности встречается в природе только в виде соединений. Наиболее важные минералы фосфора - апатит Са5(РО4)3X (Х - фтор, реже хлор и гидроксильная группа) и фосфорит, основой которого является Са3(РО4)2. Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, в Московской, Калужской, Брянской областях и в других местах. Фосфор входит в состав некоторых белковых веществ, содержащихся в генеративных органах растений, в нервных и костных тканях организмов животных и человека. Особенно богаты фосфором мозговые клетки.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C 3CaSiO3+5CO+2P
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Слайд 8
Химические свойства
Электронная конфигурация атома фосфора
1s22s22p63s23p3
Наружный электронный
слой содержит 5 электронов. Наличием трех неспаренных электронов на
внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность фосфора равна 3.
Но на третьем энергетическом уровне имеются вакантные ячейки d- орбиталей, поэтому при переходе в возбужденное состояние 3S-электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5(P2O5, H3PO4), реже +3(P2O3, PF3), -3(AlP, PH3, Na3P, Mg3P2).
Слайд 9
Белый фосфор
Белая модификация фосфора, получающаяся при конденсации паров,
имеет молекулярную кристаллическую решетку, в узлах которой дислоцированы молекулы
Р4. Из-за слабости межмолекулярных сил белый фосфор летуч, легкоплавок, режется ножом и растворяется в неполярных растворителях, например в сероуглероде. Белый фосфор весьма реакционноспособное вещество.
Он энергично взаимодействует с кислородом, галогенами, серой и металлами.
Окисление фосфора на воздухе сопровождается разогреванием и свечением.
Поэтому белый фосфор хранят под водой, с которой он не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Слайд 10
Техника безопасности. В производстве фосфора и его соединений

требуется соблюдение особых мер предосторожности, т.к. белый фосфор –
сильный яд.
Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей.
Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах.
Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком.
Обожженную кожу следует промыть раствором KMnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
При длительном хранении, а также при нагревании белый фосфор переходит в красную модификацию (впервые его получили лишь 1847 году). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, и по сравнению с белым фосфором они менее реакционноспособны и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи.
Слайд 11
Красный и черный фосфор
Красный фосфор находит применение в
металлургии, производстве полупроводниковых материалов и ламп накаливания, используется в
спичечном производстве.
Наиболее стабильной модификацией фосфора является черный фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.2). Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Слайд 12
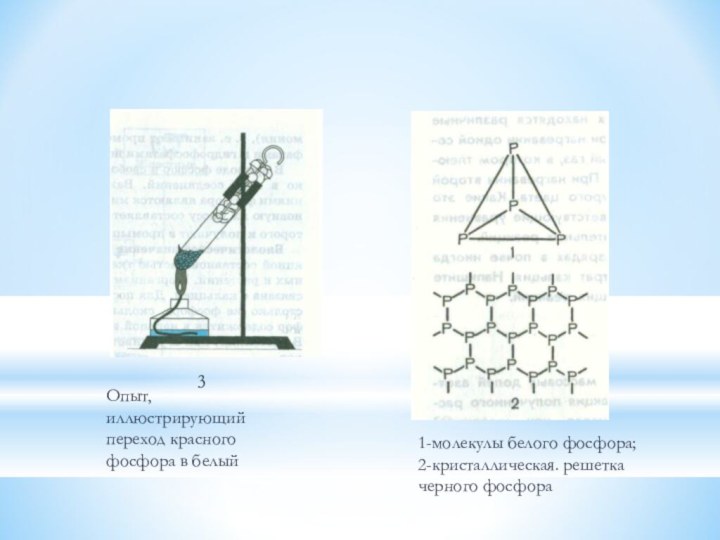
Опыт, иллюстрирующий переход красного фосфора в белый
1-молекулы белого
фосфора; 2-кристаллическая. решетка черного фосфора
3
Слайд 13
Оксид фосфора (V) - Р2О5
Фосфор
образует несколько оксидов.
Важнейшим из них является оксид фосфора
(V) P4O10.
Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора.
Белые кристаллы, t пл.= 5700оС, t кип.= 6000оC, ρ= 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение:
4P + 5O2 = 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO =Ba3(PO4)2
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества.
Слайд 14
Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор.
Важнейшая из
них — ортофосфорная кислота Н3РО4
Безводная ортофосфорная кислота представляет
собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35оС. С водой фосфорная кислота образует растворы любых концентраций.
Слайд 15
Фосфор в организме человека
В теле человека массой 70
кг. Содержится около 780 г. фосфора. В виде фосфатов
кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденозинтрифосфорная кислота, АТФ).
Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г.
Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5/1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Слайд 16
Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора
и порошка стекла. В состав спичечной головки входят окислители
(PbO2,
KСlO3, BaCrO4) и восстановители (S, Sb2S3). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется.
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. 6P + 5KCLO3 = 5KCL + 3P2O5
Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками, как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Слайд 17
Значение фосфора
Фосфорная кислота имеет большое значение как один

из важнейших компонентов питания растений. Фосфор используется растениями для
построения своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме.
Слайд 18
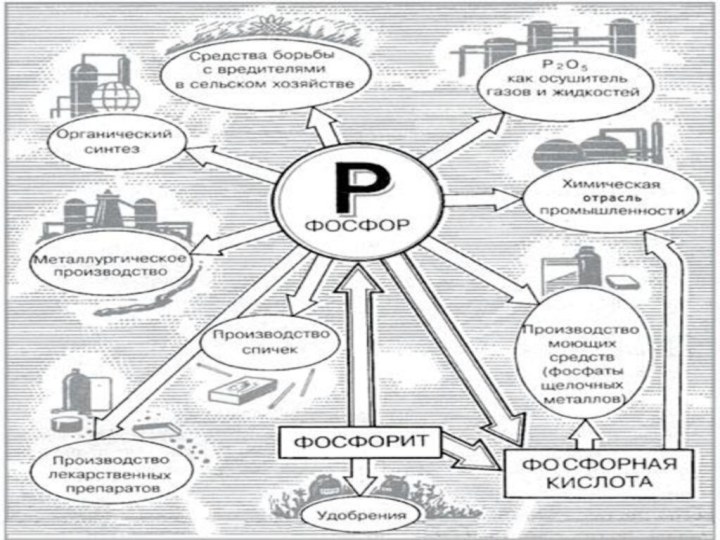
Применение фосфора
Применяют ортофосфорную кислоту в настоящее
время довольно широко.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело
в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности.
Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Слайд 19
Различные соли фосфорной кислоты широко применяют во многих
отраслях промышленности, в строительстве, разных областях техники, в коммунальном
хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.