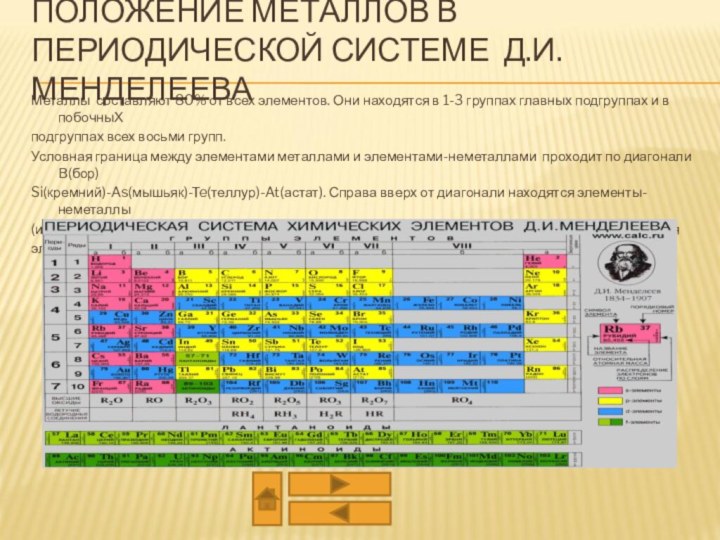
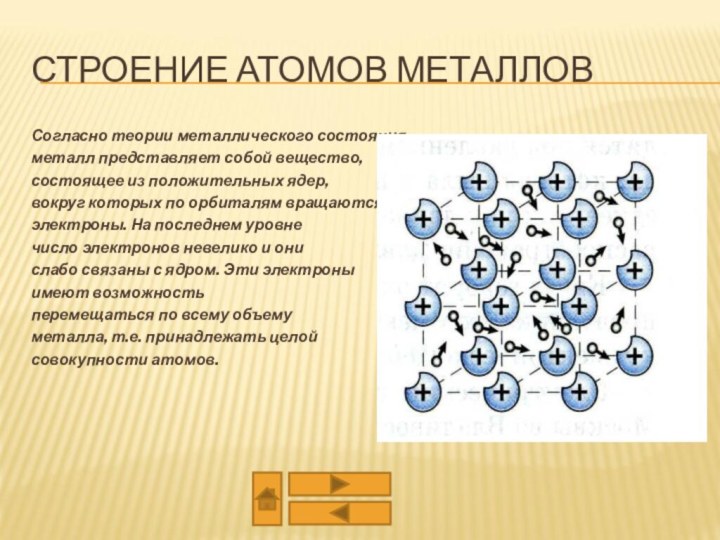
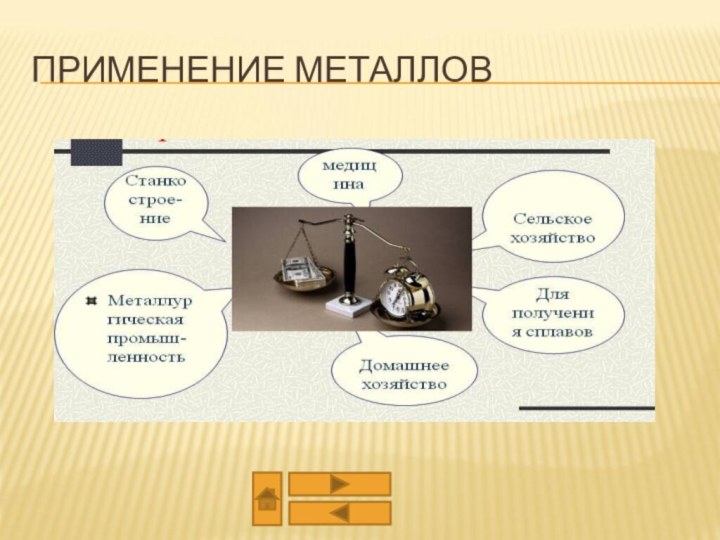
из двух или более компонентов, из которых один металл.
Представители
сплавов:
Бронза-сплав меди с другими элементами, в основном металлами. В зависимости от состава различают: оловянную бронзу, алюминиевую бронзу, свинцовую бронзу, кремниевую бронзу. Применяют для изготовления частей машин и для художественных отливок.
Латунь-сплав меди с цинком. Обладает высокой пластичностью. Используют для изготовления приборов, деталей машин, предметов домашнего обихода.
Нихром-сплав никеля, хрома, железа и марганца, обладает большим электрическим сопротивлением и жаропрочностью, поэтому его применяют для изготовления электрических нагревательных приборов.
Припой «третник»- легкоплавкий сплав, состоит из олова и свинца. Используют при паянии.
Победит-сплав углерода, вольфрама, кобальта. По твердости он близок к алмазу, применяют в металлообработке и при бурении горных пород.
Дюралюминий-сплав алюминия, магния, меди и марганца. Очень прочный и легкий сплав. По прочности он равен стали, но в три раза легче её. Применяют в самолетостроении.
Мельхиор-сплав, состоящий из меди и никеля, похож по внешнему виду на серебро. Используется для изготовления недорогих столовых и художественных изделий.
Чугун-сплав на основе железа, углерода, марганца, кремния, фосфора, серы. Применяется для изготовления массивных деталей.
Сплав из олова и индия используют для спайки стекла и металла.
Сплавы рения с танталом и вольфрамом - самые жаростойкие из всех известных.
Легкие сплавы на основе титана сохраняют прочность и коррозийную устойчивость при повышенных температурах и давлениях. Из них изготавливают отдельные части реактивных двигателей, корпуса атомных подводных лодок.