- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
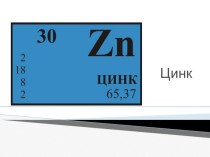
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии для 8 класса Кислотные оксиды
Содержание
- 2. Оксиды – сложные вещества, образованные атомами двух элементов, одним из которых является кислород.
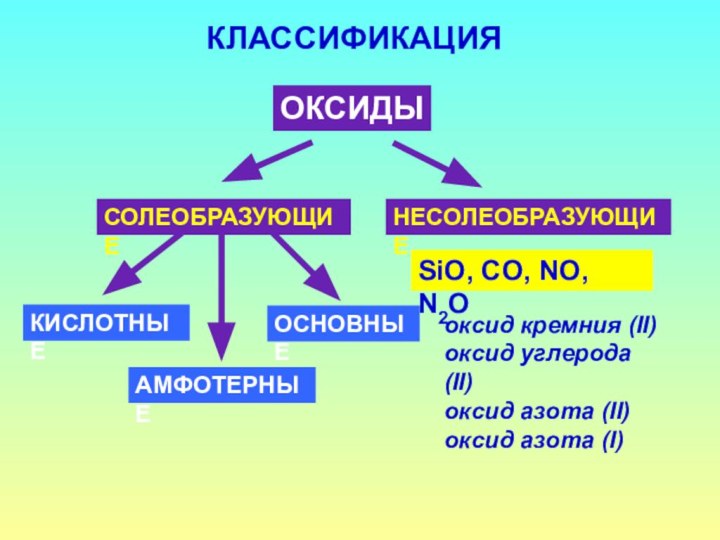
- 3. КЛАССИФИКАЦИЯОКСИДЫСОЛЕОБРАЗУЮЩИЕНЕСОЛЕОБРАЗУЮЩИЕSiO, CO, NO, N2OКИСЛОТНЫЕОСНОВНЫЕАМФОТЕРНЫЕоксид кремния (II)оксид углерода (II)оксид азота (II)оксид азота (I)
- 4. КИСЛОТНЫЕ ОКСИДЫКислотные оксиды – это такие оксиды,
- 5. КИСЛОТНЫЕ ОКСИДЫРАСТВОРИМЫЕНЕРАСТВОРИМЫЕоксид кремния (IV),диоксид кремния,кремниевый ангидрид,кварцевый песококсид
- 6. оксид фосфора (V),пентаоксид фосфора,фосфорный ангидридоксид серы (VI),триоксид
- 7. Оксид фосфора (V)Пентаоксид фосфораФосфорный ангидридРОVII25
- 8. Оксид кремния (IV)Диоксид кремнияКремниевый ангидридSiОIVII2Кварцевый песок
- 9. Оксид бораБорный ангидридВОIIIII23
- 10. Оксид хрома (VI)Триоксид хромаХромовый ангидридСrОVIII3
- 11. Оксид азота (IV)Диоксид азотаНЕ ангидридNОIVII2
- 12. Оксид вольфрама (VI)Триоксид вольфрамаВольфрамовый ангидридWОVIII3
- 13. Определить аналоги:СO2H2СO3SO2H2SO3SO3H2SO4IVIVIVIVVIVIP2O5H3PO4VVCl2O7HClO4VIIVIICrO3H2CrO4VIVI
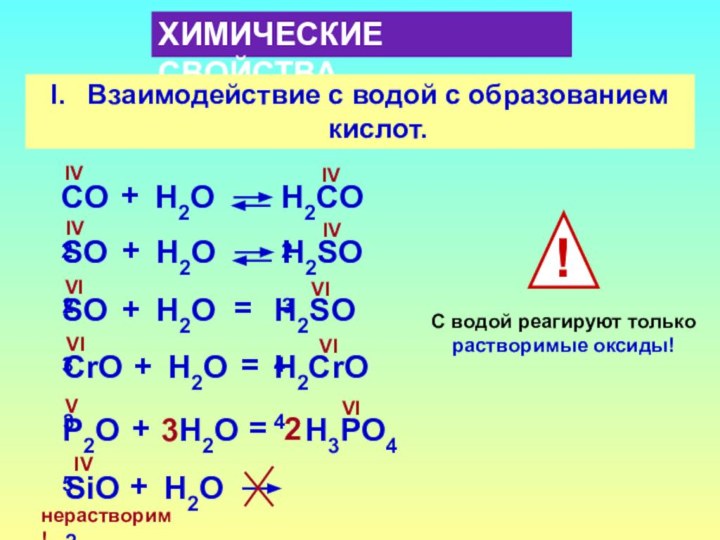
- 14. ХИМИЧЕСКИЕ СВОЙСТВАВзаимодействие с водой с образованием кислот.СO2H2СO2IVIV+Н2OSO2H2SO3IVIV+Н2OSO3H2SO4VIVI+Н2O=CrO3H2CrO4VIVI+Н2O=P2O5H3PO4VVI+Н2O=32SiO2IV+Н2Oнерастворим!С водой реагируют только растворимые оксиды!
- 15. II. Взаимодействие с основными оксидами с образованием солей.СO2СO3+Na2O=H2CO3IIкарбонат натрия2NaSO3SO4+CaO=H2SO4IIсульфат кальцияCaP2O5PO4+BaO=H3PO4IIIфосфат барияBa3()23IIIII
- 16. III. Взаимодействие с основаниями с образованием соли и воды.СO2СO3+NaOН=H2CO3IIкарбонат натрия2NaI+Н2O2SO3SO4+Ca(OН)2=H2SO4IIсульфат кальцияCaII+Н2OP2O5PO4+Ba(OН)2=H3PO4IIIфосфат барияBa3()23II+Н2O3
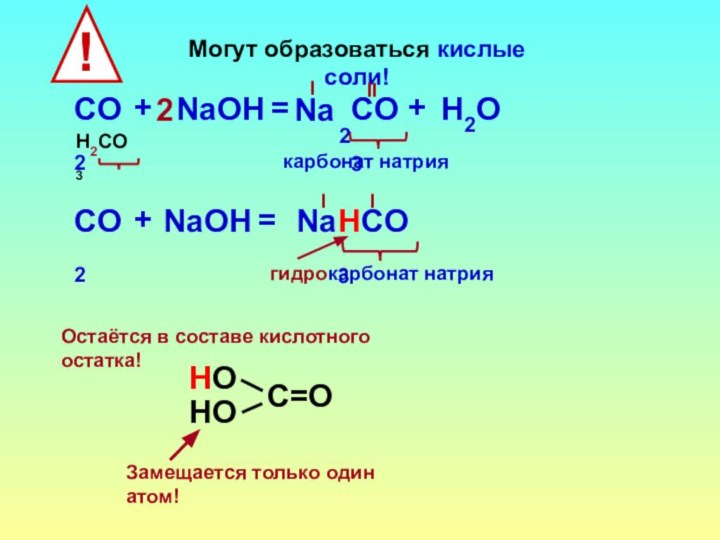
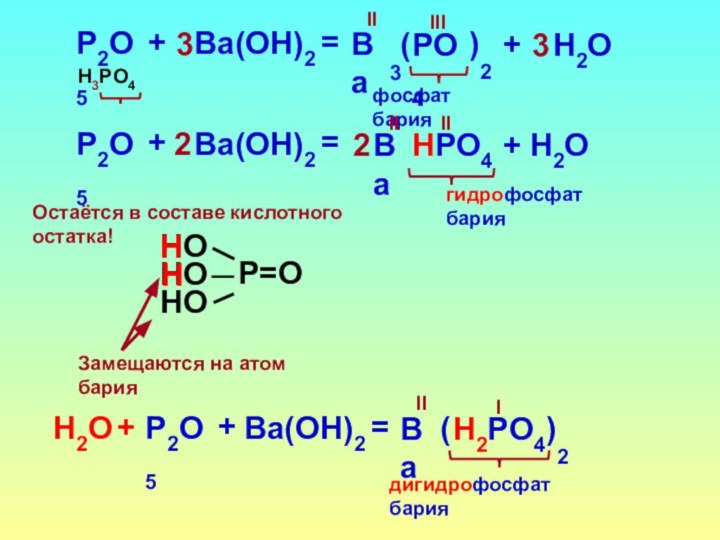
- 17. Могут образоваться кислые соли!СO2НСO3+NaOН=Iгидрокарбонат натрияNaIЗамещается только один атом!НОстаётся в составе кислотного остатка!
- 18. P2O5НPO4+Ba(OН)2=IIгидрофосфат барияBa2II+Н2O2Замещаются на атом барияОстаётся в составе кислотного остатка!НP2O5Н2PO4+Ba(OН)2=Iдигидрофосфат барияBa()2IIН
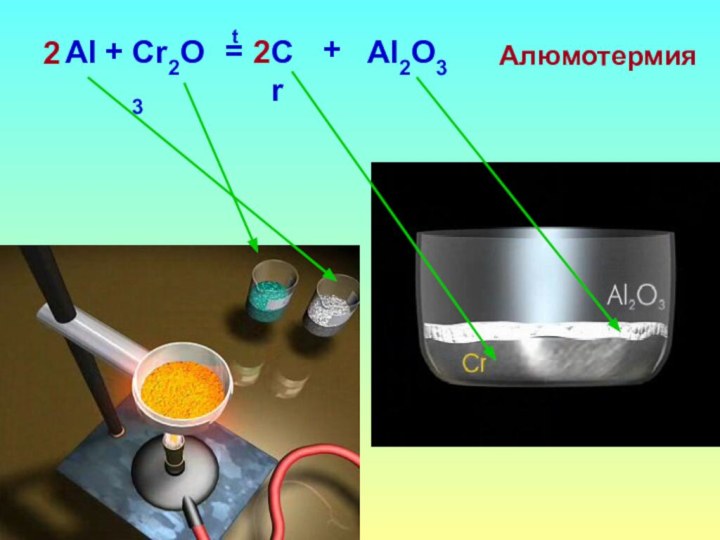
- 19. IV. Индивидуальные свойства.SO2SO3+O2=VIIV22V2O5, tCO2CO+C=2раск.MgMgO+CO2=+COраск.MgMgO+CO2=2+Cраск.2H2W+WO3=3+H2O2t23H2Mo+MoO3=3+H2O2t23Водородотермия
- 20. Скачать презентацию
- 21. Похожие презентации
Оксиды – сложные вещества, образованные атомами двух элементов, одним из которых является кислород.















Слайд 3
КЛАССИФИКАЦИЯ
ОКСИДЫ
СОЛЕОБРАЗУЮЩИЕ
НЕСОЛЕОБРАЗУЮЩИЕ
SiO, CO, NO, N2O
КИСЛОТНЫЕ
ОСНОВНЫЕ
АМФОТЕРНЫЕ
оксид кремния (II)
оксид углерода (II)
оксид
азота (II)
оксид азота (I)
Слайд 4
КИСЛОТНЫЕ ОКСИДЫ
Кислотные оксиды – это такие оксиды, которые
реагируют с основаниями с образованием соли и воды.
Кислотным оксидам
соответствуют кислоты. Кислотные оксиды образуют неметаллы (любая валентность) и металлы с валентностью > IV.
СO2, SiO2, SO2, Р2O5, Сl2O7
Слайд 5
КИСЛОТНЫЕ ОКСИДЫ
РАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
оксид кремния (IV),
диоксид кремния,
кремниевый ангидрид,
кварцевый песок
оксид углерода
(IV),
диоксид углерода,
угольный ангидрид,
углекислый газ
оксид серы (IV),
диоксид серы,
сернистый ангидрид,
сернистый газ
СO2
SO2
SiO2
Слайд 6
оксид фосфора (V),
пентаоксид фосфора,
фосфорный ангидрид
оксид серы (VI),
триоксид серы,
серный
ангидрид
оксид азота (IV),
диоксид азота
оксид хрома (VI),
триоксид хрома,
хромовый ангидрид
оксид хлора
(VII),гептаоксид хлора,
хлорный ангидрид
SO3
Р2O5
NO2
CrO3
Cl2O7