- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Закон Авогадро (8 класс)
Содержание
- 2. Существует физическая величина, прямо пропорциональная числу частиц,
- 3. В системе СИ единицей количества вещества (ν)
- 4. Установлено12 г изотопа углерода-12 содержит6,02·1023 атомовСледовательно:
- 5. Молярная массамасса одного моля вещества.М=[г/моль] молярная масса численно равна молекулярной массе, отсюда и
- 6. Что вам известно из курса физики о
- 8. Закон Авогадро
- 9. Цели урокаИзучить закон объёмных отношений Гей-
- 10. оИзмеряя объемы, и объемы газов, полученных в результате реакции. Открыл закон газовых отношений. Ж.Л. Гей-Люссак1808
- 11. Закон объёмных отношений
- 12. Например
- 13. Закон объёмных отношений позволил итальянскому учёному
- 14. ооА. Авогадро1811Открытый Гей-Люссаком закон объемных отношений предполагал
- 15. ооЗакон Авогадро (для газов)В равных объемах различных
- 16. Следствия (для газов)Одно и то же число
- 18. Vm =22,4л/мольМвозд.=29г/мольNA =6,02*1023 1/мольКонстанты:М вещества численно равна относительной молекулярной массе.
- 19. Взаимосвязь физических величин D2=M1/M2 M= ρ*VmV=ν*Vm N= ν*NAm= ρ*Vm = ν* М
- 20. Гремучий газ – смесь водорода Н2 и
- 21. Рудничный газ или метан СН4, -
- 22. Запах сернистого газа SO2 знает каждый, кто
- 23. За час взрослый человек выдыхает примерно 40
- 24. 4,48 л560 л10 г32 г/моль17 г/мольОтветы к задачам
- 25. Скачать презентацию
- 26. Похожие презентации




![Презентация по химии на тему Закон Авогадро (8 класс) Молярная массамасса одного моля вещества.М=[г/моль] молярная масса численно равна молекулярной массе, отсюда и](/img/tmb/6/581267/3b952d096364751a94c9f8ef9e2b494b-720x.jpg)



















Слайд 3
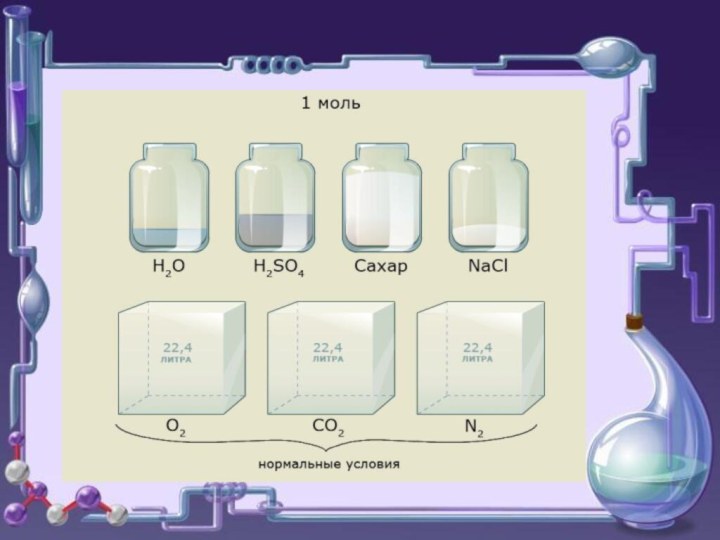
В системе СИ единицей количества вещества (ν) является
МОЛЬ
– количество вещества,
содержащее столько же частиц (атомов, молекул, ионов),
сколько
содержится атомов в 12 г углерода.
Слайд 4
Установлено
12 г изотопа углерода-12 содержит
6,02·1023 атомов
Следовательно:
1
моль – порция вещества, содержащая число частиц,
равное числу
Авогадро: NA=6,02 ·1023 моль-1
Слайд 5
Молярная масса
масса одного моля вещества.
М=[г/моль]
молярная масса численно
равна молекулярной массе
, отсюда и
Слайд 6
Что вам известно из курса физики о газообразном
состоянии вещества?
Газообразные вещества состоят из молекул.
Молекулы газов движутся беспорядочно
на большом расстоянии.Газы могут легко сжиматься и расширяться.
В газообразном состоянии вещества не имеют формы и приобретают форму сосуда, в котором находятся.
Слайд 9
Цели урока
Изучить закон объёмных отношений Гей-
Люссака.
Изучить закон Авогадро и
следствия, вытекающие из закона.Научиться решать задачи по теме.
Слайд 10
о
Измеряя объемы, и объемы газов, полученных в результате
реакции. Открыл закон газовых отношений.
Ж.Л. Гей-Люссак
1808
Слайд 11
Закон объёмных отношений
При постоянных давлении и
температуре объёмы
вступающих в реакцию газов относятся друг к другу как
простые целые числа.
Слайд 13
Закон объёмных отношений позволил итальянскому
учёному А. Авогадро
предположить, что молекулы простых газов состоят из двух одинаковых
атомов. Рассмотрим пример: 1л водорода соединяется с одним литром хлора, образуя 2л хлороводорода. При соединении молекулы распадаются на атомы, а последние образуют молекулы хлороводорода. Поскольку из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода, объём последнего должен быть равен сумме двух объёмов исходных газов.Н2 + Cl2 = 2HCl
Слайд 14
о
о
А. Авогадро
1811
Открытый Гей-
Люссаком закон объемных отношений предполагал общее
для всех газов. Это свойство впоследствии было выявлено итальянским
физиком А.Авогадро
Слайд 15
о
о
Закон Авогадро (для газов)
В равных объемах различных газов
при одинаковых температуре и давлении содержится одинаковое число частиц.
Слайд 16
Следствия (для газов)
Одно и то же число молекул
различных газов при одинаковых условиях занимает одинаковые объемы.
При н.у.
1 моль любого газа занимает объем 22,4 л.Отношение массы определённого объёма одного газа к массе такого же объёма другого газа, взятого при тех же условиях, называется плотностью первого газа по второму
Слайд 18
Vm =22,4л/моль
Мвозд.=29г/моль
NA =6,02*1023 1/моль
Константы:
М вещества численно равна относительной
молекулярной массе.
Слайд 20
Гремучий газ – смесь водорода Н2 и кислорода
в соотношении 2:1 по объёму. При поджигании смесь взрывается.
Вычислите объёмы водорода и кислорода, взятых количеством вещества 0,9 моль и 0,45 моль соответственно (н.у.). Соответствуют ли эти объёмы соотношению веществ в гремучем газе?Решение:
2Н2 + О2 = 2Н2О
2 : 1
0,9моль
0,45 моль
20,16 л
10,08 л
V(Н2) = 0,9моль * 22,4 л/моль=20,16 л
V(О2) = 0,45 моль * 22,4 л/моль= 10,08 л
20,16 :10,08 = 2 : 1
V=ν*Vm
Слайд 21
Рудничный газ или метан СН4,
- настоящее бедствие
для шахтёров. Его взрывы в шахтах приводят к большим
разрушениям и гибели людей. Г.Дэви изобрёл безопасную шахтёрскую лампу. В ней пламя было окружено медной сеткой и не вырывалось за её пределы, поэтому метан не нагревался до температуры воспламенения. Победу над рудничным газом считают гражданским подвигом Г.Дэви. Если количество вещества метана при н.у. равно 23,88 моль, то каков объём этого газа , вычисленный в литрах? Решение:V=ν*Vm
V = 23,88 моль *22,4 л/моль = 534,91 л
Слайд 22
Запах сернистого газа SO2 знает каждый, кто хоть
раз зажигал спичку. Этот газ хорошо растворяется в воде:
в 1л воды можно растворить 42 л сернистого газа. Определите массу сернистого газа, которую можно растворить в 10 литрах воды. Решение:V=ν*Vm
М(SO2 ) = 64 г/моль
V1(SO2) = 42 л
V1(Н2О) = 1 л
V2(Н2О) = 10 л
42 л SO2 растворяется в 1 л воды
х л SO2 -- в 10 л воды
х = 42* 10/1 = 420 л
ν = 420л/ 22,4 л/моль = 18,75 моль
ν = V/Vm
m = ν* М
m = 18,75 моль * 64 г/моль = 1200 г
----------------------
m(SO2) - ?
Слайд 23
За час взрослый человек выдыхает примерно 40 г
углекислого газа. Определите объём (н.у.) данной массы этого газа.
Решение:
m
= ν* МV=ν*Vm
ν = m/M
М(СO2 ) = 44 г/моль
m(СO2 ) = 40 г
---------------------
V(CO2) - ?
ν(СО2) = 40 г / 44 г/моль = 0,91 моль
V(CO2) =0,91 моль * 22,4 л/моль = 20,38 л