в смеси
Массовая доля элемента
Объёмная доля газа
Мольная доля вещества
Средняя молярная
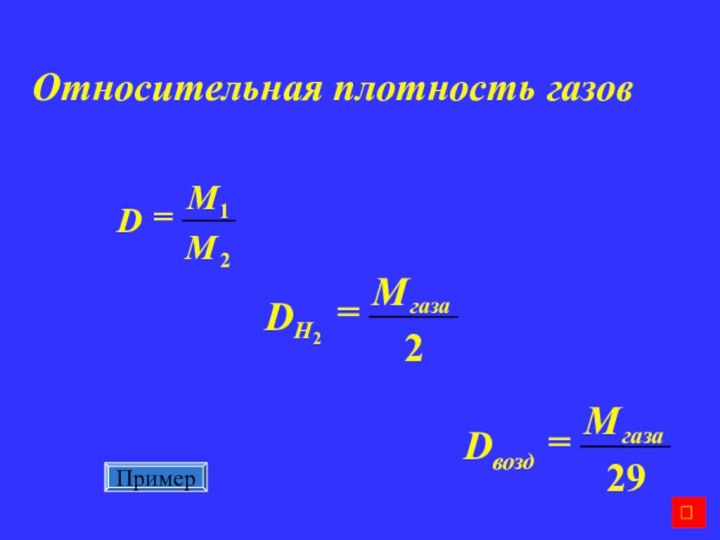
масса смеси газовМассовая доля газа
Объединённый газовый закон Бойля – Мариотта и Гей-Люссака
Уравнение Менделеева – Клапейрона
Массовая доля растворённого вещества
Массовая доля растворённого вещества в смешанном растворе
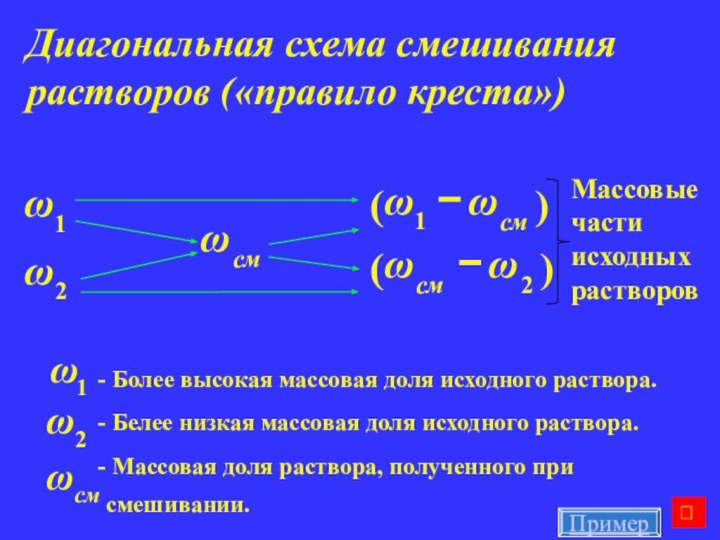
Диагональная схема смешивания растворов («правило креста»)
Молярная концентрация растворённого вещества
Скорость химической реакции
Закон действующих масс
Правило Вант-Гоффа
Молярная масса (для газов)
Плотность вещества