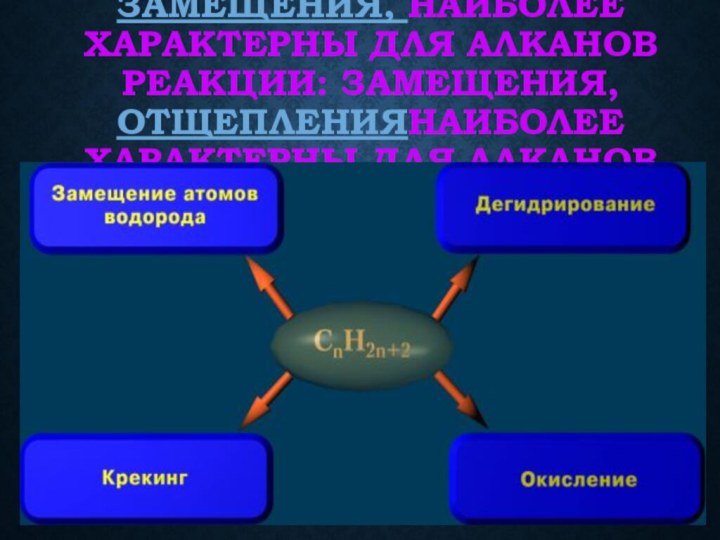
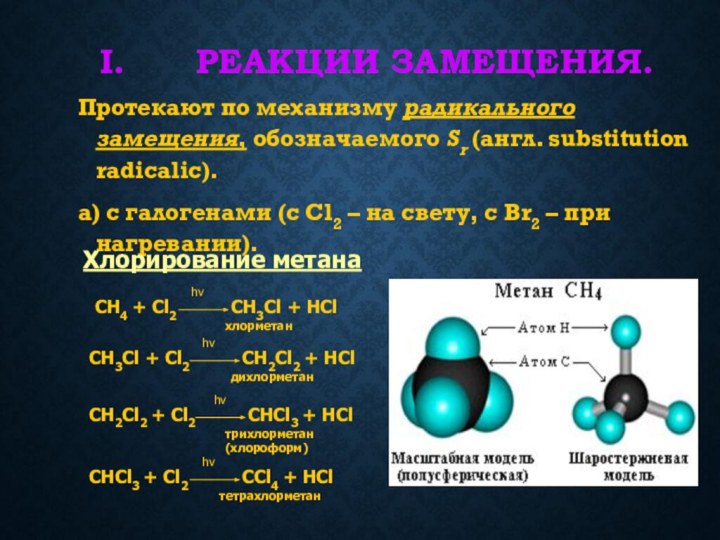
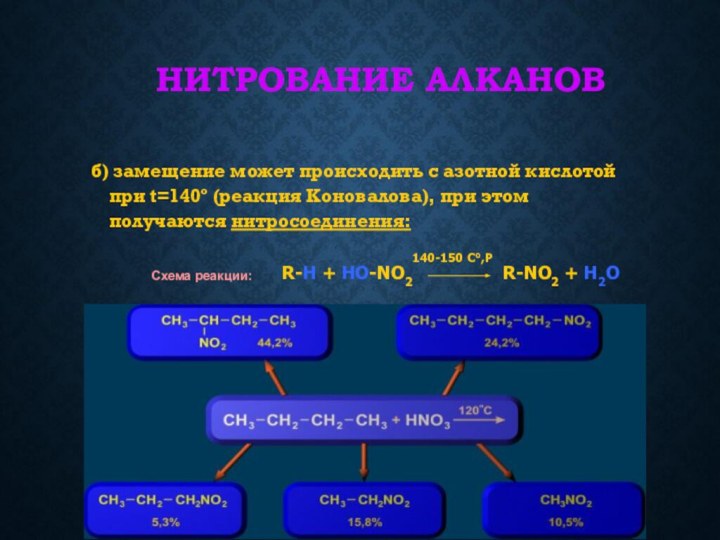
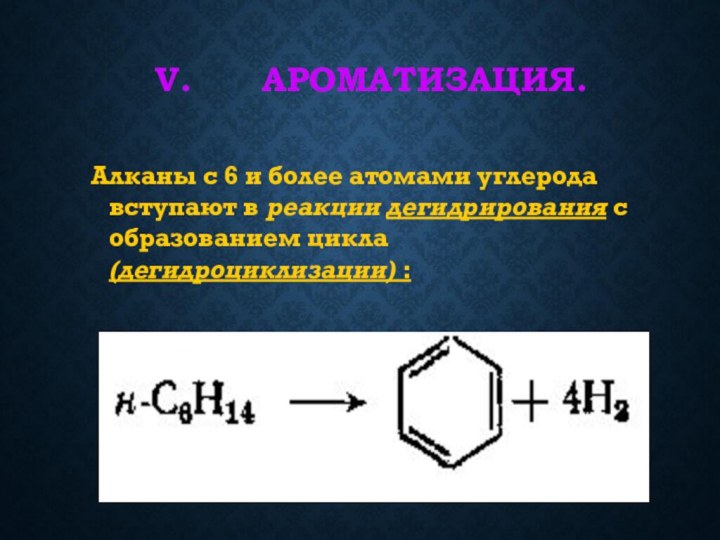
связей С-С и С-Н, а также их неполярностью. Неполярные
связи С-С и С-Н не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия KMnO4 и т. п.