- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Виды химических реакций.Виды химических реакций
Содержание
- 2. Химическая реакция.Хими́ческая реа́кция — превращение одного или
- 3. Химические реакции.реакции соединения;реакции разложения;реакции одинарного замещения;реакции двойного замещения;реакции окисления;окислительно-восстановительные реакции.
- 5. Признаки химических реакций.Признаки химических реакций. По ним
- 6. По изменению степеней окисления реагентов.Окислительно-восстановительные реакции, в
- 8. Химические реакции всегда сопровождаются физическими эффектами: поглощением
- 9. Реакция одинарного замещения.В результате реакций одинарного замещения,
- 11. По тепловому эффекту реакции.Все химические реакции сопровождаются
- 12. Реакция двойного замещения.В реакциях двойного замещения происходит
- 13. Реакции разложения.Эти реакции являются, как бы, противоположными
- 14. Причины химических реакций.Химические реакции происходят при смешении
- 16. Реакция соединения.В реакциях соединения хотя бы два
- 18. По фазовому составу реагирующей системы. Химическая реакция,
- 19. Растворимые ионные соединения:соединения NH4+соединения щелочных металловацетатынитратыхлоратысульфатыНерастворимые ионные соединения:оксидысульфатыбольшинство фосфатовбольшнинство гидроксидовсульфаты: PbSO4; BaSO4; SrSO4
- 20. Реакции нейтрализации Реакции нейтрализацииЭто реакции взаимодействия кислот
- 21. Реакции окисления Это реакции взаимодействия веществ с
- 22. Окислительно-восстановительные реакцииЭто реакции при которых происходит обмен
- 23. Скачать презентацию
- 24. Похожие презентации
Химическая реакция.Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции), сопровождающееся разрывом и/или образованием химических связей. В отличие от ядерных реакций, при химических



















Слайд 3
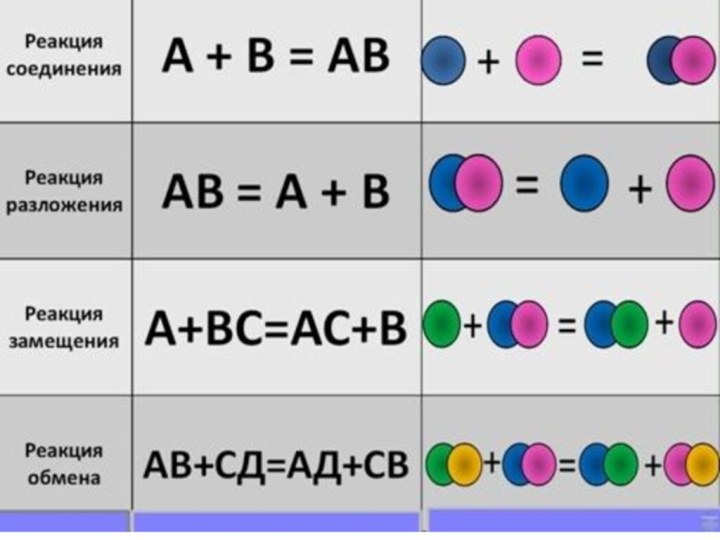
Химические реакции.
реакции соединения;
реакции разложения;
реакции одинарного замещения;
реакции двойного замещения;
реакции
окисления;
окислительно-восстановительные реакции.
Слайд 5
Признаки химических реакций.
Признаки химических реакций. По ним можно
судить, прошла ли химическая реакция между реагентами или нет.
К таким признакам принято относить следующие:- Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа - химическая реакция взаимодействия железа с кислородом).
- Выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция).
- Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).
- Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
- Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Слайд 6
По изменению степеней окисления реагентов.
Окислительно-восстановительные реакции, в которых
атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою
степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции конпропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
2 H2 + O2 = 2 H2O
Пример реакции конпропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
NH4NO3 = N2O + 2 H2O (до 250 °C)
Не относятся к окислительно-восстановительным реакции, в которых не происходит изменения степеней окисления атомов, например, BaCl2 + Na2SO4 = 2 NaCl + BaSO4(осадок)
Слайд 8 Химические реакции всегда сопровождаются физическими эффектами: поглощением или
выделением энергии, изменением окраски реакционной смеси и др. Именно
по этим физическим эффектам часто судят о протекании химических реакций.Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически любые вещества, которые в природе находятся в ограниченных количествах, например, азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Слайд 9
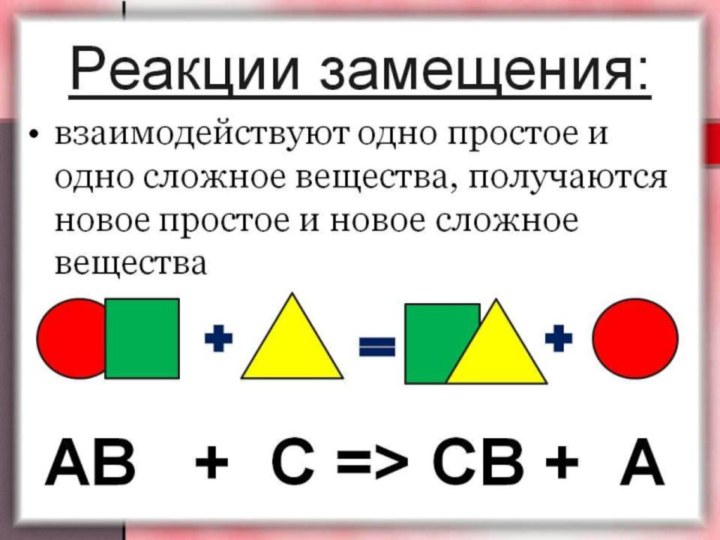
Реакция одинарного замещения.
В результате реакций одинарного замещения, более
активный элемент замещает в соединении менее активный:
Zn(т) +
CuSO4 (р-р) → ZnSO4 (р-р) + Cu(т) Цинк в растворе сульфата меди вытесняет менее активную медь, в результате чего образуется раствор сульфата цинка.
Степень активности металлов по возрастанию активности:
Au Ag Cu Pb Sn Ni Fe Cr Al
Наиболее активными являются щелочные и щелочноземельные металлы
Ионное уравнение вышеприведенной реакции будет иметь вид:
Zn(т) + Cu2+ + SO42- → Zn2+ + SO42- + Cu(т)
Ионная связь CuSO4 при растворении в воде распадается на катион меди (заряд 2+) и анион сульфата (заряд 2-). В результате реакции замещения образуется катион цинка ( который имеет такой же заряд, как и катион меди: 2-). Обратите внимание, что анион сульфата присутствует в обеих частях уравнения, т.е., по всем правилам математики его можно сократить. В итоге получится ионно-молекулярное уравнение:
Zn(т) + Cu2+ → Zn2+ + Cu(т)
Слайд 11
По тепловому эффекту реакции.
Все химические реакции сопровождаются выделением
или поглощением энергии. При разрыве химических связей в реагентах
выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение.
Слайд 12
Реакция двойного замещения.
В реакциях двойного замещения происходит замещение
уже двух электронов. Такие реакции еще называют реакциями обмена.
Такие реакции проходят в растворе с образованием:нерастворимого твердого вещества (реакции осаждения);
воды (реакции нейтрализации).
Реакции осаждения
При смешивании раствора нитрата серебра (соль) с раствором хлорида натрия образуется хлорид серебра:
Молекулярное уравнение: KCl(р-р) + AgNO3 (p-p) → AgCl(т) + KNO3 (p-p)
Ионное уравнение: K+ + Cl- + Ag+ + NO3- → AgCl(т) + K+ + NO3-
Молекулярно-ионное уравнение: Cl- + Ag+ → AgCl(т)
Если соединение растворимое, оно будет находиться в растворе в ионном виде. Если соединение нерастворимое, оно будет осаждаться, образовывая твердое вещество.
Слайд 13
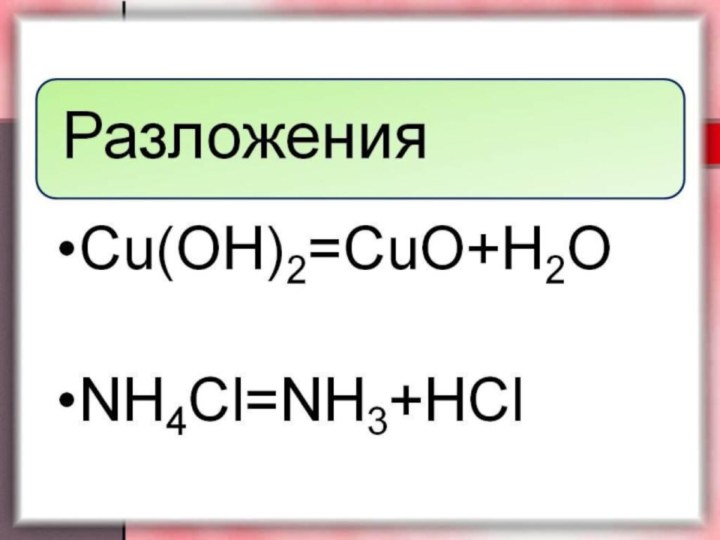
Реакции разложения.
Эти реакции являются, как бы, противоположными по
сути, реакциям соединения. В результате реакции разложения вещество распадается
на два (3, 4...) более простых элемента (соединения):2H2O(ж) → 2H2 (г) + O2 (г) - разложение воды
2H2O2 (ж) → 2H2 (г)O + O2 (г) - разложение перекиси водорда
Слайд 14
Причины химических реакций.
Химические реакции происходят при смешении или
физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ),
действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Слайд 16
Реакция соединения.
В реакциях соединения хотя бы два элемента
образуют один продукт:
2Na(т) + Cl2 (г) → 2NaCl(т)
- образование поваренной соли. Следует обратить внимание на существенный нюанс реакций соединения: в зависимости от условий протекания реакции или пропорций реагентов, вступающих в реакцию, - ее результатом могут быть разные продукты. Например, при нормальных условиях сгорания каменного угля получается углекислый газ: C(т) + O2 (г) → CO2 (г)
Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ: 2C(т) + O2 (г) → 2CO(г)
Слайд 18
По фазовому составу реагирующей системы.
Химическая реакция, протекающая
в пределах одной фазы, называется гомогенной химической реакцией. Химическая
реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В многостадийной химической реакции некоторые стадии могут быть гомогенными, а другие — гетерогенными. Такие реакции называются гомогенно-гетерогенными.В зависимости числа фаз, которые образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными (исходные вещества и продукты находятся в пределах одной фазы) и гетерофазными (исходные вещества и продукты образуют несколько фаз). Гомо- и гетерофазность реакции не связана с тем, является ли реакция гомо- или гетерогенной. Поэтому можно выделить четыре типа процессов:
Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(ж.)
Гетерогенные гомофазные реакции. Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе:
C2H4(газ) + H2(газ) → C2H6(газ)
Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах нескольких фаз, однако реакция протекает в одной фазе. Так может проходить окисление углеводородов в жидкой фазе газообразным кислородом.
Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
MgCO3(тв.) + 2 HCl(раств.) → MgCl2(раств.) + CO2(газ) + H2O(ж.)
Слайд 19
Растворимые ионные соединения:
соединения NH4+
соединения щелочных металлов
ацетаты
нитраты
хлораты
сульфаты
Нерастворимые ионные соединения:
оксиды
сульфаты
большинство
фосфатов
большнинство гидроксидов
сульфаты: PbSO4; BaSO4; SrSO4
Слайд 20
Реакции нейтрализации
Реакции нейтрализации
Это реакции взаимодействия кислот и оснований,
в результате которых образуются молекулы воды.
Например, реакция смешивания
раствора серной кислоты и раствора гидроксида натрия (щелока): Молекулярное уравнение: H2SO4 (p-p) + 2NaOH(p-p) → Na2SO4 (p-p) + 2H2O(ж)
Ионное уравнение: 2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O(ж)
Молекулярно-ионное уравнение:2H+ + 2OH- → 2H2O(ж) или H+ + OH- → H2O(ж)
Слайд 21
Реакции окисления
Это реакции взаимодействия веществ с газообразным кислородом,
находящимся в воздухе, при которых, как правило, выделяется большое
количество энергии в виде тепла и света. Типичная реакция окисления - это горение. В самом начале данной страницы приведена реакция взаимодействия метана с кислородом:CH4 (г) + 2O2 (г) → CO2 (г) + 2H2O(г)
Метан относится к углеводородам (соединения из углерода и водорода). При реакции углеводорода с кислородом выделяется много тепловой энергии.
Слайд 22
Окислительно-восстановительные реакции
Это реакции при которых происходит обмен электронами
между атомами реагентов. Рассмотренные выше реакции, также являются окислительно-восстановительными
реакциями:2Na + Cl2 → 2NaCl - реакция соединения
CH4 + 2O2 → CO2 + 2H2O - реакция окисления
Zn + CuSO4 → ZnSO4 + Cu - реакция одинарного замещения