из атомов металла и одной или нескольких
гидроксогрупп(количество их зависит от валентности металлов)
1. Действие на индикаторы
Фенолфталеин+щёлочь
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






Реакция нейтрализации – реакция между кислотой и основанием
2. Взаимодействие с кислотами
Cu(OH)2 + H2SO4→CuSO4 + 2H2O
нерастворимое + кислота = соль + вода
основание
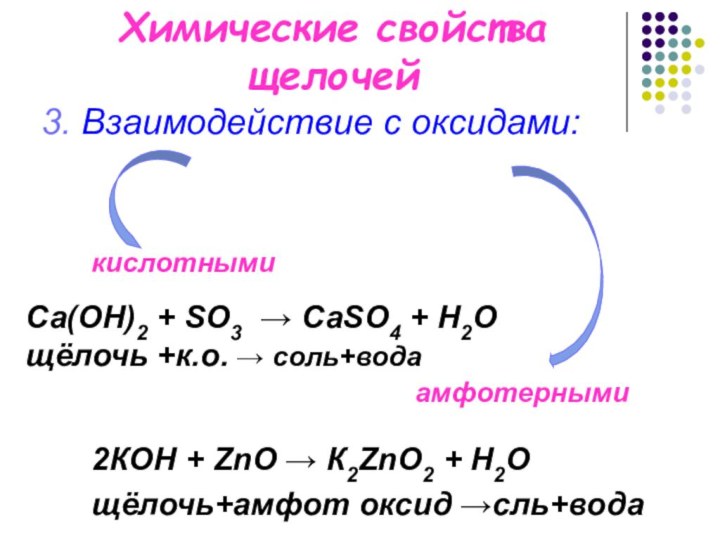
кислотными
амфотерными
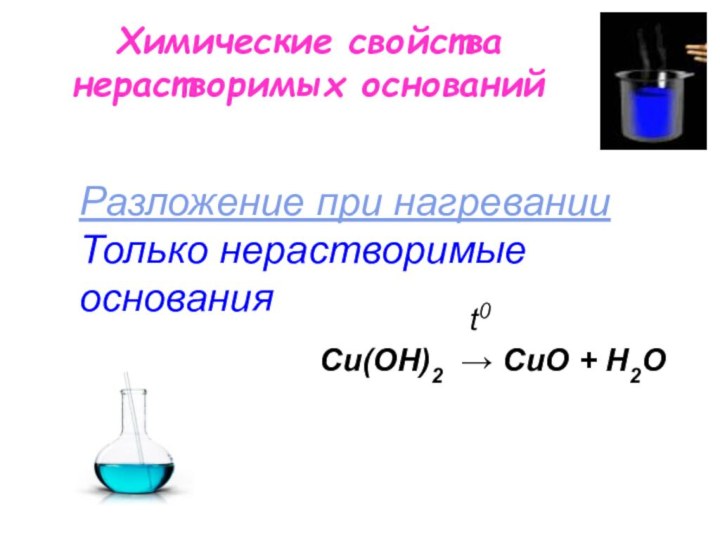
Разложение при нагревании
Только нерастворимые основания