- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Спирты
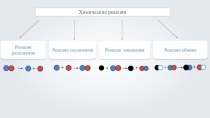
Содержание
- 2. Спирты – это производные углеводородов,где один или несколько водородных атомовзамещены на гидроксогруппу.
- 3. Гомологический ряд спиртов
- 4. Функциональная группа спиртовПри смещении электронной плотности от
- 5. Водородная связьУменьшение расстояния
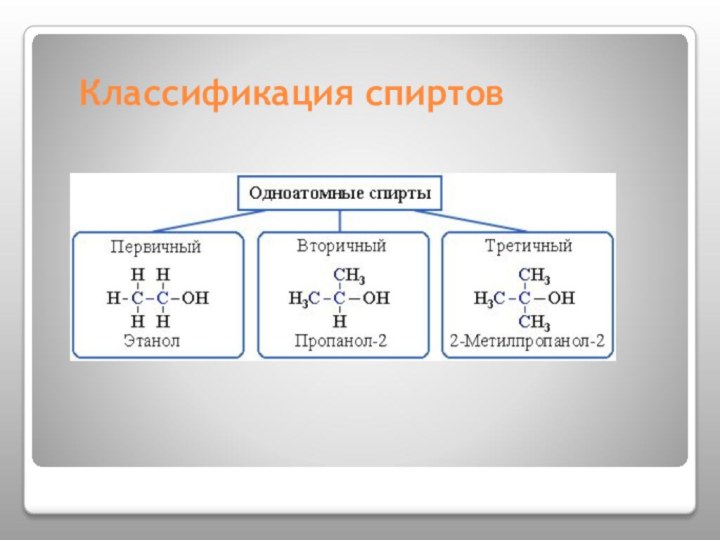
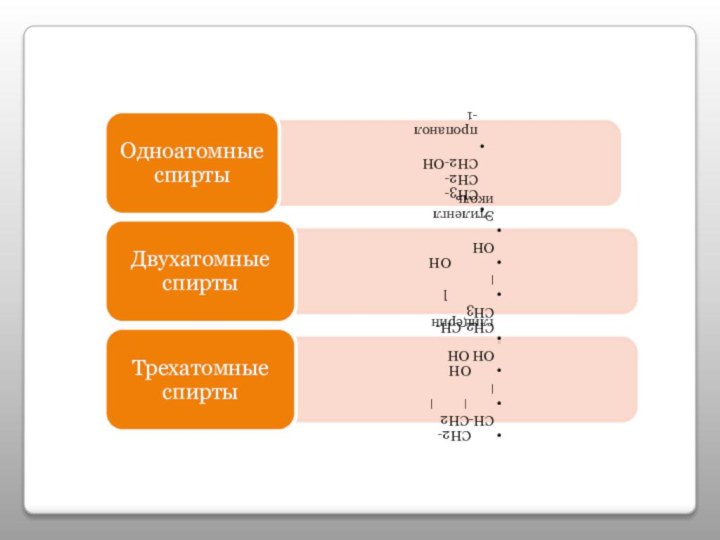
- 6. Классификация спиртов
- 8. Номенклатура спиртовСистематические названия даются по названию углеводорода
- 10. Химические свойства спиртов1. Взаимодействие с галогеноводородами, подобно взаимодействию щелочей с кислотами2. Дегидратация. А) внутримолекулярная
- 11. Б) межмолекулярная3. ГорениеС2Н5ОН + 3 О2 →
- 12. 4. Спирты взаимодействуют со щелочными и щелочно-земельными
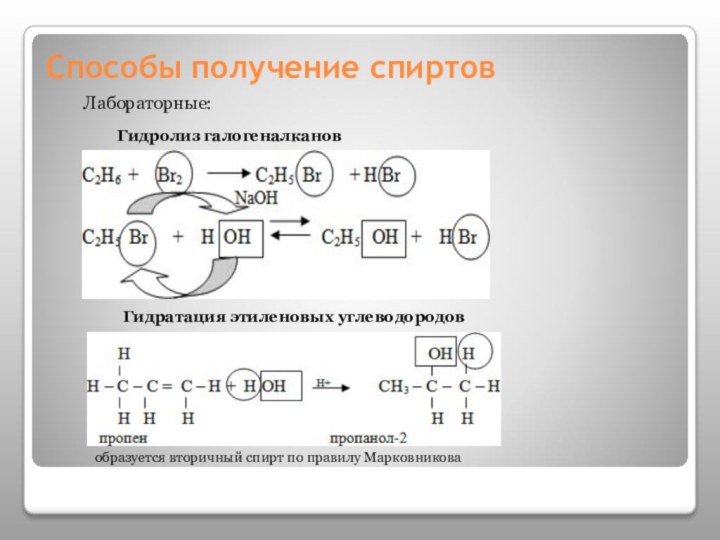
- 13. Способы получение спиртовЛабораторные:Гидролиз галогеналканов Гидратация этиленовых углеводородовобразуется вторичный спирт по правилу Марковникова
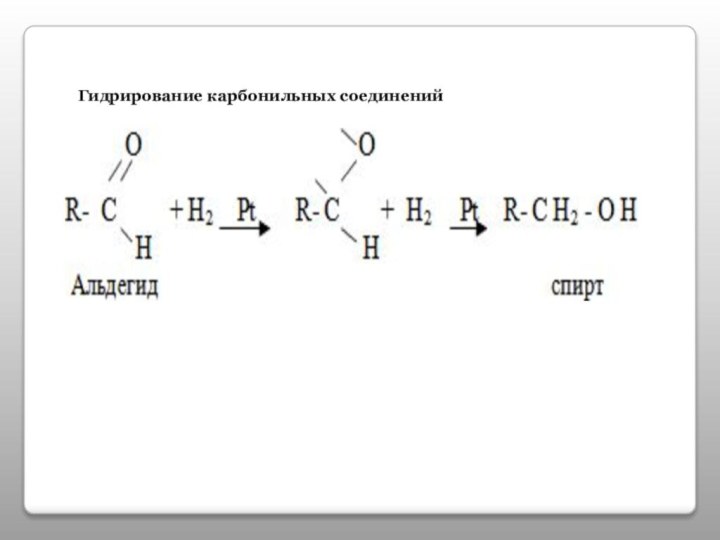
- 14. Гидрирование карбонильных соединений
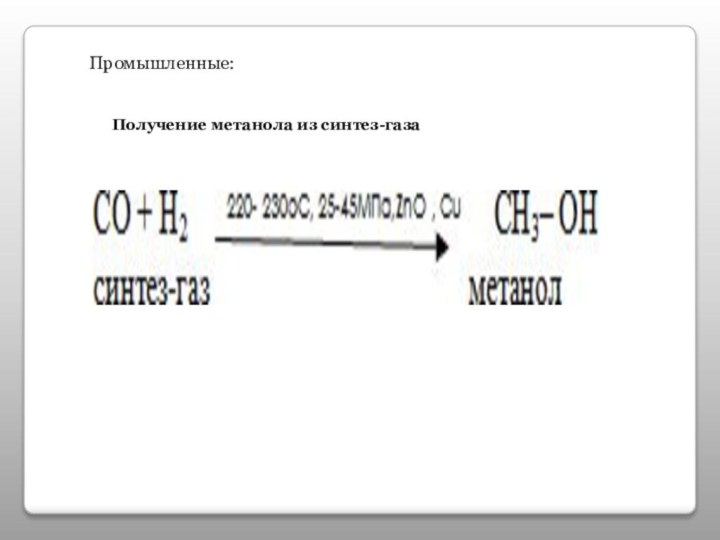
- 15. Промышленные:Получение метанола из синтез-газа
- 16. Применение спиртовПолучение лекарств
- 17. Обеззараживание
- 18. Производство лаков и красок
- 19. При проведении клинического анализа крови
- 20. В качестве автомобильного топлива
- 21. Как добавка к реактивному топливу
- 22. В качестве растворителя
- 23. Сырье для получения каучука
- 24. Сырье для производства уксусной кислоты
- 25. Проверь себя1. Общая формула предельных одноатомных спиртов а) CnH2n+2 б) CnH2n в) CnH2n-2 г) CnH2n+1OH
- 26. 2. Функциональная группа предельных одноатомных спиртов а)
- 27. 3. Реакции по разрыву связи в гидроксогруппе
- 28. Реакция с отрывом гидроксогруппы а) окисление; б) гидрирование; в) гидратация; г) дегидратация (+)
- 29. Скачать презентацию
- 30. Похожие презентации
Спирты – это производные углеводородов,где один или несколько водородных атомовзамещены на гидроксогруппу.























Слайд 4
Функциональная группа спиртов
При смещении электронной плотности от водорода
к кислороду, возможна некоторая подвижность
атома водорода, что приводит к
появлению слабыхкислотных свойств.
Слайд 5
Водородная связь
Уменьшение расстояния между
молекулами спиртов
приводит к тому, что среди спиртов нет газообразных
Веществ,
но температура кипения их низкая.
Слайд 8
Номенклатура спиртов
Систематические названия даются по названию углеводорода с
добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если
это необходимо). Например:Нумерация ведется от ближайшего к ОН-группе конца цепи.
Слайд 9
Изомерия спиртов
1.
Для спиртов характерна структурная изомерия:
изомерия положения ОН-группы (начиная с
С3)2. углеродного скелета (начиная с С4)
3. межклассовая изомерия с простыми эфирами
СН3-CH2–OH и CH3–O–CH3
Слайд 10
Химические свойства спиртов
1. Взаимодействие с галогеноводородами, подобно
взаимодействию щелочей с кислотами
2. Дегидратация.
А) внутримолекулярная
Слайд 11
Б) межмолекулярная
3. Горение
С2Н5ОН + 3 О2 →
2 СО2 + 3 Н2О
С3Н7ОН +
4,5 О2 → 3 СО2 + 4 Н2ОС3Н7ОН + 9 О2 → 6 СО2 + 8 Н2О
Слайд 12
4. Спирты взаимодействуют со щелочными и
щелочно-земельными металлами
2СН3-СН2-ОН
+ 2К → 2СН3-СН2-ОК + Н2
2СН3-СН2-ОН + Са →
(СН3-СН2-О)2Са + Н2
Слайд 13
Способы получение спиртов
Лабораторные:
Гидролиз галогеналканов
Гидратация этиленовых углеводородов
образуется вторичный
спирт по правилу Марковникова
Слайд 25
Проверь себя
1. Общая формула предельных одноатомных спиртов
а)
CnH2n+2
б) CnH2n
в) CnH2n-2
г) CnH2n+1OH
Слайд 26
2. Функциональная группа предельных одноатомных спиртов
а)
- СНО
б) - СООН
в) - ОН
г) - СН3
Слайд 27
3. Реакции по разрыву связи
в гидроксогруппе
а)
с галогенами;
б) с кислородом;
в) с
активными металлами;г) с оксидом меди (ІІ);