- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Щелочные металлы(9 класс)
Содержание
- 2. Щелочны́е мета́ллы — элементы главной подгруппы первой
- 3. Строение и свойства атомовЩелочные металлы – это
- 4. Характер простых веществ
- 5. ЛИТИЙЛитий был открыт в 1817 году шведским
- 6. НАТРИЙНатрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
- 7. НАТРИЙ Природные соединения Натрия — поваренная
- 8. КАЛИЙВ 1807 году английский химик Дэви электролизом
- 9. КАЛИЙ Некоторые соединения Калия (например,
- 10. РУБИДИЙВ 1861 году немецкие учёные Роберт Вильгельм
- 11. ЦЕЗИЙЦезий был открыт в 1860 году немецкими
- 12. ФРАНЦИЙСуществование и главные свойства самого тяжёлого аналога
- 13. ФРАНЦИЙ Франций - щелочной металл, обладающий
- 14. Химические свойстваУравнения реакций щелочных металлов с неметаллами
- 15. Химические свойстваПри взаимодействии с кислородом натрий образует
- 16. Химические свойстваВсе щелочные металлы активно взаимодействуют с
- 17. Соединения щелочных металлов Оксиды Оксиды М2О
- 18. Соединения щелочных металлов Гидроксиды Гидроксиды МОН
- 19. Соли щелочных металлов Карбонат натрия (Na2CO3)
- 20. Соли щелочных металлов Гидрокарбонат натрия (NaHCO3)
- 21. Соли щелочных металлов Карбонат калия (K2CO3)
- 22. Соли щелочных металлов Кристаллогидрат сульфата натрия (Na2So4*10H2O)Кристаллогидрат
- 23. Соединения щелочных металлов Хлорид натрия (NaCl)
- 24. Скачать презентацию
- 25. Похожие презентации
Щелочны́е мета́ллы — элементы главной подгруппы первой группы Периодической Системы. Название связано с тем, что при взаимодействии щелочных металлов с водой образуется едкая щёлочь. К щелочным металлам относятся (в порядке увеличения атомного номера) литий (Li), натрий






















Слайд 3
Строение и свойства атомов
Щелочные металлы – это элементы
главной подгруппы I группы Периодической системы химических элементов Д.И.
Менделеева: литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs), Францией(Fr).На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Слайд 5
ЛИТИЙ
Литий был открыт в 1817 году шведским химиком
и минералогом А. Арфведсоном сначала в минерале петалите, а
затем в сподумене и в лепидолите. Металлический литий впервые получил Хамфри Дэви в 1825 году.Мягкий щелочной металл серебристо-белого цвета.
Слайд 6
НАТРИЙ
Натрий впервые был получен английским химиком Хемфри Дэви
в 1807 году электролизом твердого NaOH.
Слайд 7
НАТРИЙ
Природные соединения Натрия — поваренная соль
NaCl, сода Na2CO3 — известны с глубокой древности. Название
«натрий», происходящее от араб. натрун, греч. nitron, первоначально относилось к природной соде. Уже в 18 в. химики знали много др. соединений натрия. Однако сам металл был получен лишь в 1807 Г. Дэви электролизом едкого натра NaOH. В Великобритании, США, Франции элемент называется sodium (от исп. слова soda — сода), в Италии — sodio.Натрий - мягкий щелочной металл серебристо-белого цвета, его можно резать ножом.
Слайд 8
КАЛИЙ
В 1807 году английский химик Дэви электролизом твёрдого
едкого кали (KOH) выделил калий и назвал его «потассий».
В 1809 году Л. В. Гильберт предложил название «калий».
Слайд 9
КАЛИЙ
Некоторые соединения Калия (например, поташ,
добывавшийся из древесной золы) были известны уже в древности;
однако их не отличали от соединений натрия . Только в 18 в. было показано различие между «растительной щёлочью» (поташем K2CO3 ) и «минеральной щёлочью» (содой Na2CO3 ). В 1807 Г. Дэви электролизом слегка увлажнённых твёрдых едких кали и натра (koh и naoh) выделил К. и натрий и назвал их потассием и содием. В 1809 Л. В. Гильберт предложил название «калий» (от араб. аль-кали — поташ) и «натроний» (от араб. натрун — природная сода); последнее И. Я. Берцелиус в 1811 изменил на «натрий». Название «потассий» и «содий» сохранились в Великобритании, США, Франции и некоторых др. странах. В России эти названия в 1840-х гг. были заменены на «калий» и «натрий», принятые в Германии,Австрии и Скандинавских странах.
Слайд 10
РУБИДИЙ
В 1861 году немецкие учёные Роберт Вильгельм Бунзен
и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа
природные алюмосиликаты, обнаружили в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра.Мягкий, серебристо-белый,
очень химически активный металл
Слайд 11
ЦЕЗИЙ
Цезий был открыт в 1860 году немецкими учёными
Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюрхгеймского минерального
источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и барияМягкий щелочной металл золотисто-белого цвета
Слайд 12
ФРАНЦИЙ
Существование и главные свойства самого тяжёлого аналога щелочных
металлов были предсказаны Д. И. Менделеевым в 1870, однако
долгое время попытки обнаружить этот элемент в природе оканчивались неудачами. Только в 1939 французской исследовательнице М. Перей удалось доказать, что ядра 227 Ac в 12 случаях из 1000 испускают a(альфа) -частицы и при этом переходят в ядра элемента № 87 с массовым числом 223, который и выделила Перей. Новый элемент исследовательница назвала в честь своей родины.
Слайд 13
ФРАНЦИЙ
Франций - щелочной металл, обладающий как
радиоактивностью, так и высокой химической активностью . Не имеет
стабильных изотопов.Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов
Уран(235),
из которого поучают франций
Слайд 14
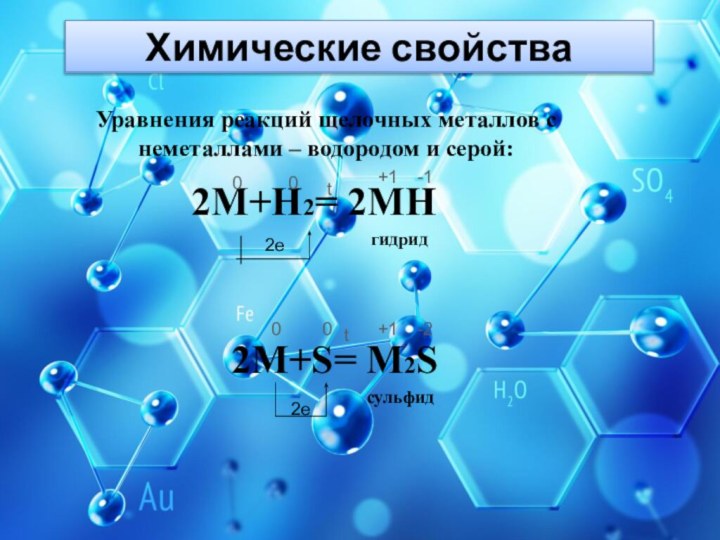
Химические свойства
Уравнения реакций щелочных металлов с неметаллами –
водородом и серой:
2М+Н2= 2МН
0
0
t
+1
-1
2е
гидрид
2М+S= М2S
2е
0
0
t
+1
-2
сульфид
Слайд 15
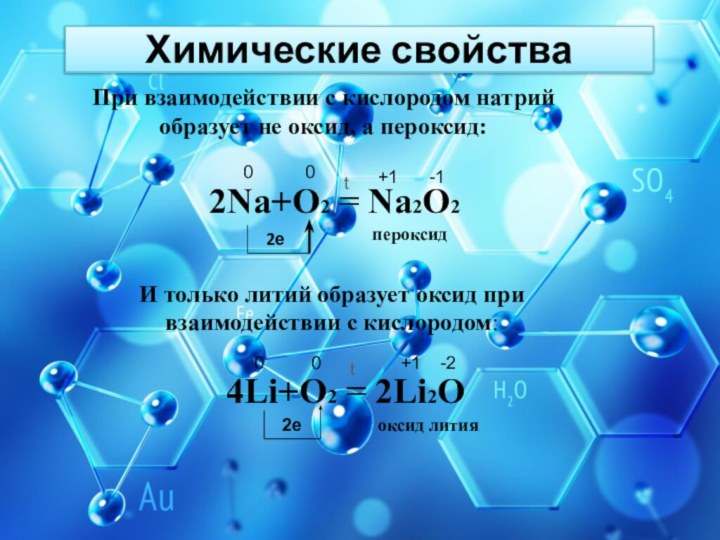
Химические свойства
При взаимодействии с кислородом натрий образует не
оксид, а пероксид:
2Na+O2 = Na2O2
0
0
2е
t
+1
-1
пероксид
И только литий образует оксид
при взаимодействии с кислородом:4Li+O2 = 2Li2O
0
0
+1
t
-2
2e
оксид лития
Слайд 16
Химические свойства
Все щелочные металлы активно взаимодействуют с водой,
образуя щелочи и восстанавливая воду до водорода:
2М+2НОН = 2МОН+Н2
+1
+1
0
0
2е
Слайд 17
Соединения щелочных металлов
Оксиды
Оксиды М2О – твердые
вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой,
кислотами и кислотными оксидами. Оксиды натрия Na2O и калия K2O получают, прокаливая пероксиды с соответствующими металлами, например:2Na + Na2O2 = 2Na2O
Слайд 18
Соединения щелочных металлов
Гидроксиды
Гидроксиды МОН – твердые
белые вещества. Очень гидроскопичны. Хорошо растворяются в воде, с
выделением большого количества теплоты. Их относят к щелочам. Гидроксид натрия NaOH в технике известен как едкий натр, каустическая сода, каустик. Техническое название гидроксида калия KOH – едкое кали. Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства жидкого мыла. Едкое кали применяют для производстважидкого мыла.