- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы химических реакций по учебнику химии 8 класса О.С.Габриеляна
Содержание
- 2. Практическое заданиеКонтекстные задачи« Лови ошибку»«Третий лишний»Спринт
- 3. «Дорогу осилит
- 5. Тема урока: «Типы химических реакций»
- 6. Цель урока: -повторить типы химических реакций и признаки их классификации; -закрепить навыки составления уравнений химических реакций.
- 7. Лестница успеха: большая цель разбивается на мелкие
- 8. I ступень-спринт.Задание : вставить пропущенные слова.Реакции между
- 9. II ступень- « Третий лишний».Задание: найдите «лишнее»
- 10. 1 вариант:1. 2NaCl = 2Na +Cl22. CaO
- 11. III ступень- « Лови ошибку».Задание: найдите ошибку в определение типа химической реакции .
- 12. Проверь себя!
- 13. IV ступень- Контекстные задачи.Задание: составьте уравнение реакции,
- 14. IV ступень- контекстные задачи.Задание: составьте уравнение реакции,
- 15. IV ступень- контекстные задачи.Задание: составьте уравнение реакции,
- 16. Проверь себя!1) При известковании кислых почв, в почву
- 17. Проверь себя!2) Компонентом некоторых зубных паст является фторид
- 18. Проверь себя!3) Больным, имеющим повышенную кислотность
- 19. Проверь себя!4) Питьевая сода применяется в
- 20. Проверь себя!5) Рыцарь в невзрачных доспехах( Fe)Видом
- 21. Проверь себя!6) В июне 1794 г. для
- 22. Проверь себя!7) Загорелся ( О2), всем на
- 23. 8) Эти образования на озере Моно (США)
- 24. V ступень- практическое задание.«Многоуважаемые коллеги-химики 8 класса!Недавно
- 25. Правила техники безопасности:• Проводить опыты лишь с теми
- 26. Что необходимо помнить при проведении уравнений реакций
- 27. Проверь себя!
- 28. Скачать презентацию
- 29. Похожие презентации
Практическое заданиеКонтекстные задачи« Лови ошибку»«Третий лишний»Спринт


























Слайд 6
Цель урока:
-повторить типы химических реакций и признаки
их классификации;
-закрепить навыки составления уравнений химических реакций.
Слайд 7
Лестница успеха: большая цель разбивается на мелкие реальные
этапы, последовательные тактические шаги, каждый из которых несложен, понятен
и выполним, а все вместе, в совокупности, они ведут к достижению искомой цели."Неудачи никогда не случаются с теми, чье стремление к успеху достаточно велико!"
Слайд 8
I ступень-спринт.
Задание : вставить пропущенные слова.
Реакции между двумя
простыми веществами, или между несколькими сложными, при этом образуется
одно сложное или более сложное вещество-…Реакции, при которых из одного сложного вещества образуется несколько простых или сложных веществ-…
Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного-…
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями-…
Реакции, протекающие с выделением теплоты и света, называются реакциями…
Реакции, протекающие с выделением теплоты , называются …
Реакции, протекающие с поглощением теплоты , называются …
Слайд 9
II ступень- « Третий лишний».
Задание: найдите «лишнее» уравнение
реакции среди трех приведенных .
1 вариант:
1. 2NaCl = 2Na
+Cl22. CaO +CO2 = CaCO3
3. C + O2 =CO2
2 вариант:
1. 2CuO +C = 2Cu + CO2
2. 2NO + O2 = 2NO2
3. Mg + H2S = MgS + H2
Слайд 10
1 вариант:
1. 2NaCl = 2Na +Cl2
2. CaO +CO2
= CaCO3
3. C + O2 =CO2
2 вариант:
1. 2CuO +C
= 2Cu + CO22. 2NO + O2 = 2NO2
3. Mg + H2S = MgS + H2
Проверь себя!
Слайд 11
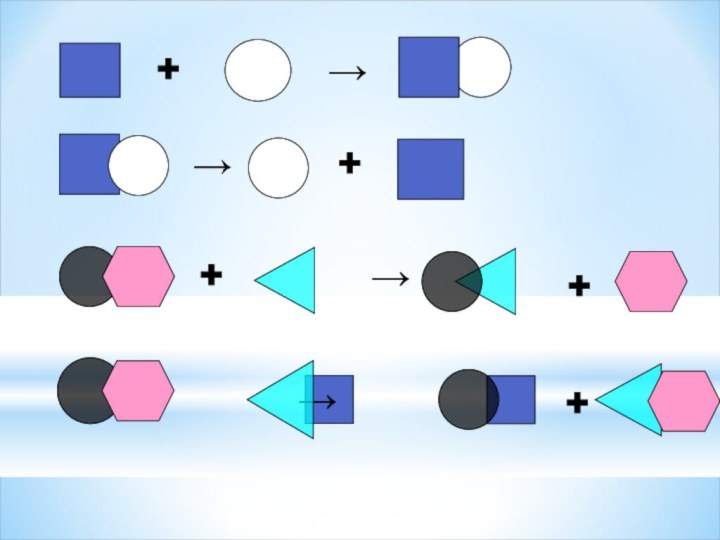
III ступень- « Лови ошибку».
Задание: найдите ошибку в
определение типа химической реакции .
Слайд 13
IV ступень- Контекстные задачи.
Задание: составьте уравнение реакции, расставьте
коэффициенты, определите тип химической реакции .
1) При известковании кислых почв,
в почву добавляют карбонат кальция или яичную скорлупу. В результате происходит реакция: СаСО3 + HCl → СаСl2 + СО2 + H2O
2) Компонентом некоторых зубных паст является фторид олова (II) , который получается при взаимодействии олова с плавиковой кислотой ( фтороводородной кислотой) . В ходе реакции образуется фторид олова (II) и водород.
3) Больным, имеющим повышенную кислотность желудка, рекомендуют лекарственный препарат, содержащий гидроксид алюминия. В желудке при приеме лекарственных препаратов, снижающих кислотность желудочного сока, происходит следующая реакция:
Al( OH)3 + HCl → AlCl3 + H2O
4) Питьевая сода применяется в кулинарии и пищевой промышленности при замесе теста. При нагревании теста выделяется газ, который разрыхляет его.
NаHСО3 → Nа2СО3 + СО2 + H2O
Слайд 14
IV ступень- контекстные задачи.
Задание: составьте уравнение реакции, расставьте
коэффициенты, определите тип химической реакции .
5) Рыцарь в невзрачных
доспехах( Fe)Видом своим удручен.
Однажды, решившись взбодриться
В голубую реку ( CuSO4) бросился он.
А вынырнув, сам удивился
Что-то сверкало на нем.
Был он обычным железным,
А стал омедненным гвоздем.
6) В июне 1794 г. для наблюдения за передвижением армии интервентов во время боя при Флёрюсе (Франция) был использован привязной воздушный шар, заполненный водородом, который получили при пропускании водяного пара через раскалённый орудийный ствол:
Fe + H2O = H2 + Fe3O4
Слайд 15
IV ступень- контекстные задачи.
Задание: составьте уравнение реакции, расставьте
коэффициенты, определите тип химической реакции .
7) Загорелся ( О2),
всем на дивоФосфор в колбочке красиво -
Получился, надо знать,
Ангидрид Р2О5!
8) Эти образования на озере Моно (США) называют туфовые башни. Они образовались в результате реакций между карбонатами озёрной воды и кальцием из подземных источников. Продукт реакции – известняк СаСО3.
Происходит следующая реакция:
Na2CO3+CaCl2 → СаСО3+ NaCl
Слайд 16
Проверь себя!
1) При известковании кислых почв, в почву добавляют
карбонат кальция или яичную скорлупу. В результате происходит реакция:
СаСО3 + 2HCl → СаСl2 + СО2 + H2O (р.обмена)
Слайд 17
Проверь себя!
2) Компонентом некоторых зубных паст является фторид олова
(II) , который получается при взаимодействии олова с плавиковой
кислотой ( фтороводородной кислотой) . В ходе реакции образуется фторид олова (II) и водород.Sn +2HF → SnF2 + H2 (р.замещения)
Слайд 18
Проверь себя!
3) Больным, имеющим повышенную кислотность желудка,
рекомендуют лекарственный препарат, содержащий гидроксид алюминия. В желудке при
приеме лекарственных препаратов, снижающих кислотность желудочного сока, происходит следующая реакция:Al( OH)3 + 3HCl → AlCl3 + 3H2O (р.обмена)
Слайд 19
Проверь себя!
4) Питьевая сода применяется в кулинарии
и пищевой промышленности при замесе теста. При нагревании теста
выделяется газ, который разрыхляет его.2NаHСО3 → Nа2СО3 + СО2 + H2O
(р.разложения)
Слайд 20
Проверь себя!
5) Рыцарь в невзрачных доспехах( Fe)
Видом своим
удручен.
Однажды, решившись взбодриться
В голубую реку ( CuSO4) бросился он.
А
вынырнув, сам удивилсяЧто-то сверкало на нем.
Был он обычным железным,
А стал омедненным гвоздем.
CuSO4 + Fe → FeSO4 + Cu (р.замещения)
Слайд 21
Проверь себя!
6) В июне 1794 г. для наблюдения
за передвижением армии интервентов во время боя при Флёрюсе
(Франция) был использован привязной воздушный шар, заполненный водородом, который получили при пропускании водяного пара через раскалённый орудийный ствол:3Fe + 4H2O → 4H2 + Fe3O4 (р.замещения)
Слайд 22
Проверь себя!
7) Загорелся ( О2), всем на диво
Фосфор
в колбочке красиво -
Получился, надо знать,
Ангидрид Р2О5!
4Р + 5О2
→2Р2О5 (р.соединения)
Слайд 23
8) Эти образования на озере Моно (США) называют
туфовые башни. Они образовались в результате реакций между карбонатами
озёрной воды и кальцием из подземных источников. Продукт реакции – известняк СаСО3.Происходит следующая реакция:
Na2CO3+CaCl2 → СаСО3+ 2NaCl (р.обмена)
Слайд 24
V ступень- практическое задание.
«Многоуважаемые коллеги-химики 8 класса!
Недавно я
познакомился с одним из типов химических реакций – реакциями
обмена. Несмотря на мои обширные познания в области химических наук, у меня возникла проблема: в моем распоряжении есть следующие реактивы – растворы соляной кислоты, карбоната натрия, хлорида магния, гидроксида натрия, сульфата натрия. Все эти вещества сложные и, следовательно, они должны вступать в реакции обмена, но на практике оказалось, что не все они между собой взаимодействуют или… взаимодействуют, но я ничего не наблюдал. Почему? Чего я не учел? Помогите мне, пожалуйста, разрешить мою проблему. Буду вам премного благодарен. Искренне ваш коллега.R.S. Вместе с письмом высылаю вам все перечисленные реактивы.»
Слайд 25
Правила техники безопасности:
• Проводить опыты лишь с теми веществами,
которые указаны учителем. Не брать для опыта больше вещества,
чем это необходимо.• Строго выполнять указанные учителем меры предосторожности.
• Не пробовать вещества на вкус.
• При определении запаха веществ не подносите сосуд близко к лицу, ибо вдыхание паров может вызвать раздражение дыхательных путей.
• Не приступайте к выполнению опыта, не зная этапов проведения опытов.
• Банки и склянки закрывайте теми же крышками и пробками, какими они были закрыты изначально. Пробки открываемых склянок ставьте на стол только тем концом, который не входит в горлышко склянки.
• Закончив работу, приведите рабочее место в порядок.
Слайд 26
Что необходимо помнить при проведении уравнений реакций обмена?
Если
выделился газ – раз,
И получится вода – это два,
А
еще нерастворимый осаждается продукт.«Есть осадок», - говорим мы.
Это третий важный пункт.
Химик правила обмена не забудет никогда:
В результате непременно будет газ или вода,
Или выпадет осадок – вот тогда порядок!
(условия протекания реакций обмена – выделение газа, выпадение осадка, образование воды)





























