- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему урока химии в 11 классе Факторы, влияющие на скорость химических реакций
Содержание
- 2. Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.Цели урока:
- 3. 1. Исследовать факторы, влияющие на скорость химических
- 4. 1. Молярная концентрация рассчитывается по формуле:
- 5. 1. Молярная концентрация рассчитывается по формуле:
- 7. Рабочее место содержать в чистоте;Не брать посуду
- 19. 2. Как изменится скорость химической реакции 2СО
- 20. Решение задачиДано:При уменьшенииобъёма смеси в 2раза концентрациякаждого
- 27. Скачать презентацию
- 28. Похожие презентации
Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.Цели урока:





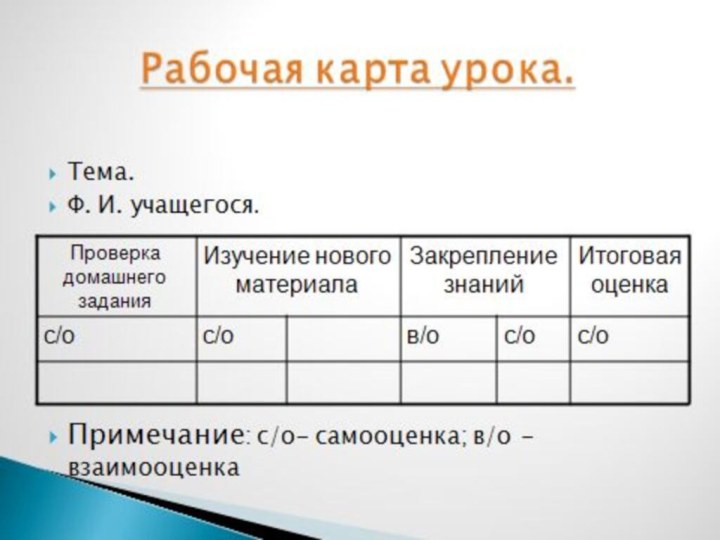

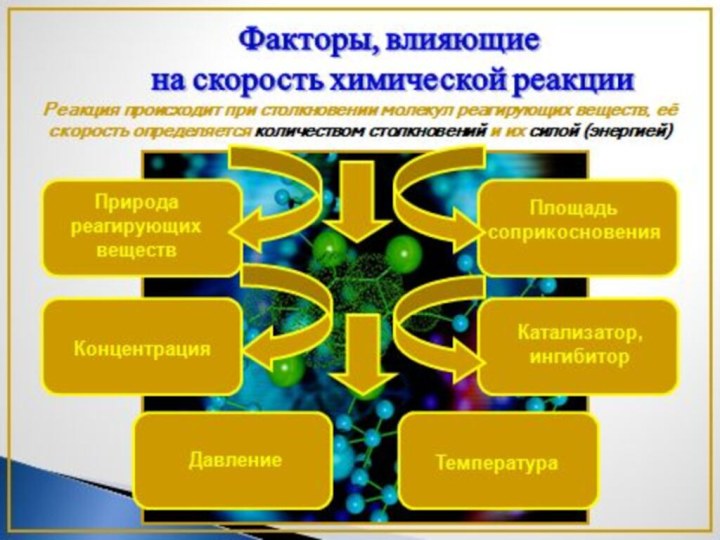



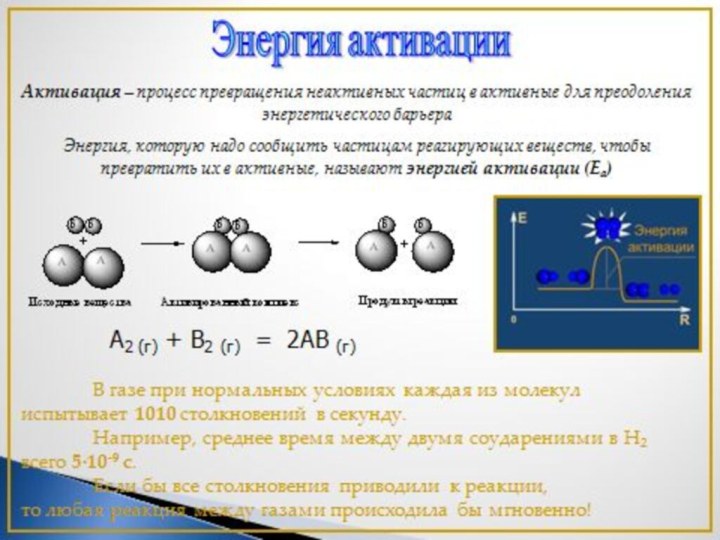















Слайд 3 1. Исследовать факторы, влияющие на скорость химических реакций
и механизм их выполнения;
2. Продолжить развитие умений устанавливать причинно-следственные
связи, проводить эксперимент, развивать умения осуществлять самоконтроль и взаимоконтроль;3. Воспитывать интерес к учению, личностные качества, обеспечивающие успешность в творческой деятельности.
Слайд 4
1. Молярная концентрация рассчитывается по формуле:
а) w = mв-ва / m р-ра
б) св-ва= nв-ва / Vв) n = m / M г) v = - ∆c / ∆t
2. Скорость химической реакции 2SO2 + O2 = 2SO3 можно рассчитать по изменению концентрации исходных веществ, используя формулу:
а) v = kc2(SO2) c(O2) б) v = - ∆c (O2) / ∆t
в) v = ∆c (SO3) / ∆t г) v = ∆c (SO2) / ∆t
Скорость химических реакций
Слайд 5
1. Молярная концентрация рассчитывается по формуле:
а) w = mв-ва / m р-ра
б) св-ва= nв-ва / Vв) n = m / M г) v = - ∆c / ∆t
2. Скорость химической реакции 2SO2 + O2 = 2SO3 можно рассчитать по изменению концентрации исходных веществ, используя формулу:
а) v = kc2(SO2) c(O2) б) v = - ∆c (O2) / ∆t
в) v = ∆c (SO3) / ∆t г) v = ∆c (SO2) / ∆t
Ответы:
Слайд 7
Рабочее место содержать в чистоте;
Не брать посуду и
реактивы с других столов;
Закрывать банки, в которых хранятся реактивы;
Не
брать реактивы голыми руками;Не использовать грязные стеклянные палочки при наборе реактива из банок;
При нагревании вещества держите сосуд отверстием от людей;
Добавлять кислоту в воду, а не наоборот;
Использованные вещества, грязную посуду складывайте в отдельную ёмкость;
По окончании работы навести порядок на столе, вымыть руки с мылом.
Правила безопасного поведения:
Слайд 19 2. Как изменится скорость химической реакции 2СО +
О2 = 2СО2, если уменьшить объем газовой смеси в
2 раза?Задача
Слайд 20
Решение задачи
Дано:
При уменьшении
объёма смеси в 2
раза концентрация
каждого вещества
возрасла
в 2 раза
c2 (смеси)/с1(смеси) = 2
Найти: v2/v1
2СО +
О2 = 2СО21) Запишем выражение закона действующих
масс для исходной смеси и после сжатия
v1 = k · c(СО)2 · c(О2)
v2 = k · c(2СО)2 · c(2О2) =
= k · 4c(СО)2 · 2c(О2) =
= 8k · c(СО)2 · c(О2)
2) Найдём отношение скоростей:
v2/v1 = (8k · c(СО)2 · c(О2))/ (k · c(СО)2 · c(О2)) = 8
Ответ: скорость реакции возрастёт в 8 раз





























