- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Галогены
Содержание
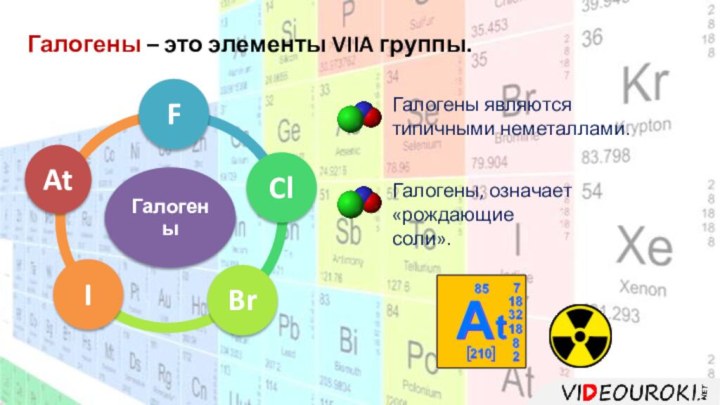
- 2. Галогены – это элементы VIIA группы.Галогены, означает «рождающиесоли». Галогены являются типичными неметаллами.
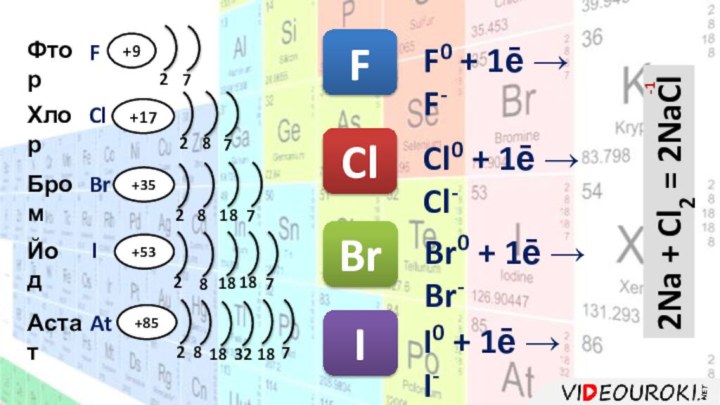
- 3. ФторХлорБромЙодАстатFClBrIAt+9+17+35+85+5377772222888181818181832Cl0 + 1ē → Cl-2Na + Cl2
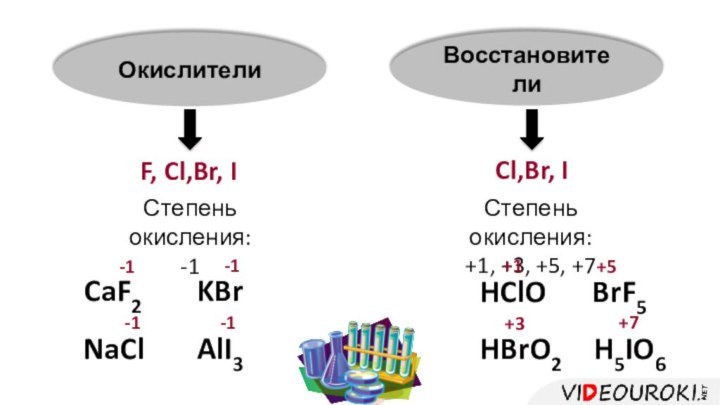
- 4. ОкислителиВосстановителиF, Cl,Br, ICl,Br, IСтепень окисления: -1Степень окисления: +1, +3, +5, +7HClOHBrO2BrF5H5IO6+1+3+5+7CaF2NaClKBrAlI3-1-1-1-1
- 5. FClBrIРадиус атома увеличиваетсяУсиливаются восстановительные свойстваУвеличиваются металлическиесвойстваF2Cl2Br2I2
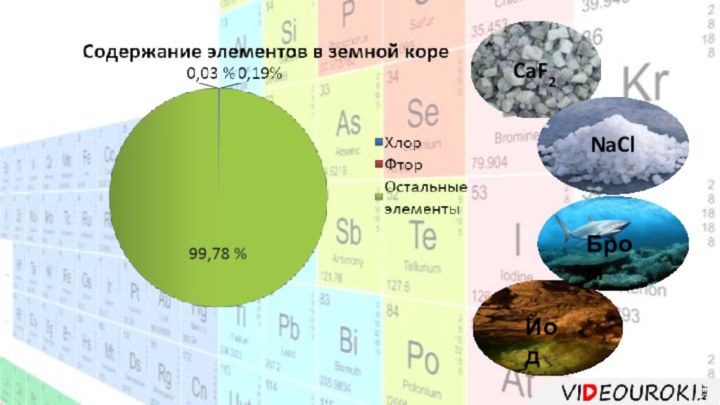
- 6. CaF2NaClБромЙод
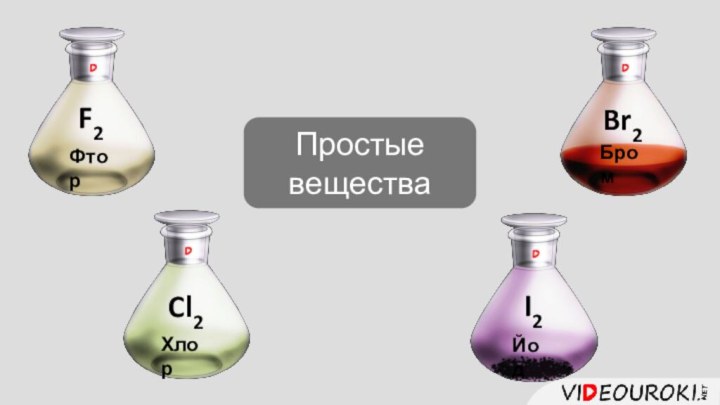
- 7. Простые веществаF2ФторCl2ХлорBr2БромI2Йод
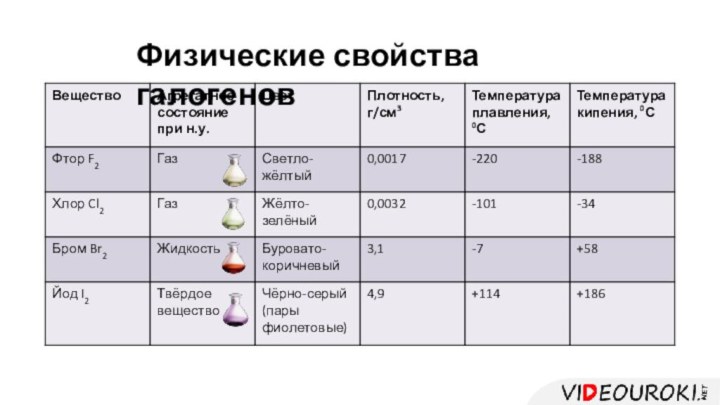
- 8. Физические свойства галогенов
- 9. Галогены – химически активные соединения.F2 – Cl2
- 10. 2Al + 3I2 = 2AlI300+3-1Йодидалюминия6ēAl – восст-льI
- 11. Фтор разлагает воду.2F2 + 2H2O = 4HF
- 12. FClBrIОт греч. фторос –«разрушающий». Получен в 1886
- 13. Галогены – это элементы VIIA группы.Молекулы галогенов
- 14. Скачать презентацию
- 15. Похожие презентации





Слайд 3
Фтор
Хлор
Бром
Йод
Астат
F
Cl
Br
I
At
+9
+17
+35
+85
+53
7
7
7
7
2
2
2
2
8
8
8
18
18
18
18
18
32
Cl0 + 1ē → Cl-
2Na + Cl2 =
2NaCl
-1
7
2
8
F
Cl
Br
I
F0 + 1ē → F-
Br0 + 1ē → Br-
I0
+ 1ē → I-
Слайд 4
Окислители
Восстановители
F, Cl,Br, I
Cl,Br, I
Степень окисления:
-1
Степень окисления:
+1,
+3, +5, +7
HClO
HBrO2
BrF5
H5IO6
+1
+3
+5
+7
CaF2
NaCl
KBr
AlI3
-1
-1
-1
-1
Слайд 5
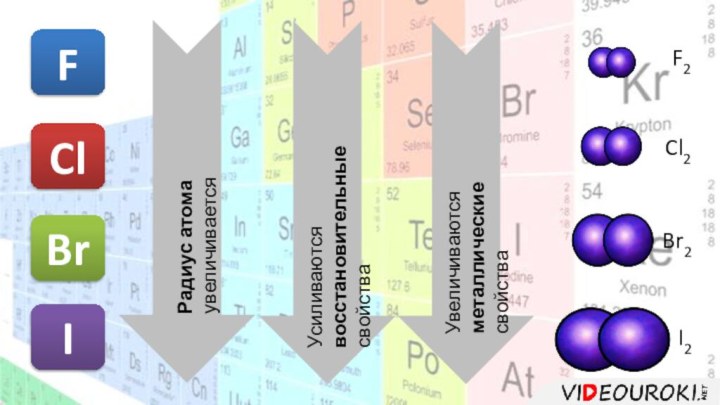
F
Cl
Br
I
Радиус атома увеличивается
Усиливаются восстановительные
свойства
Увеличиваются металлические
свойства
F2
Cl2
Br2
I2
Слайд 9
Галогены – химически активные соединения.
F2 – Cl2 –
Br2 – I2
Уменьшение активности
Фтор самый активный галоген, при нагревании
реагирует с золотом, серебром и платиной. Zn + F2 = ZnF2
t
Фторид
цинка
0
0
+2
-1
2ē
2Fe + 3Cl2 = 2FeCl3
t
Хлорид
железа (III)
0
0
+3
-1
Cu + Br2 = CuBr2
0
0
+2
-1
Бромид
меди (II)
6ē
2ē
Zn – восст-ль
Cl – ок-ль
Fe – восст-ль
F – ок-ль
t
Cu – восст-ль
Br – ок-ль
Слайд 10
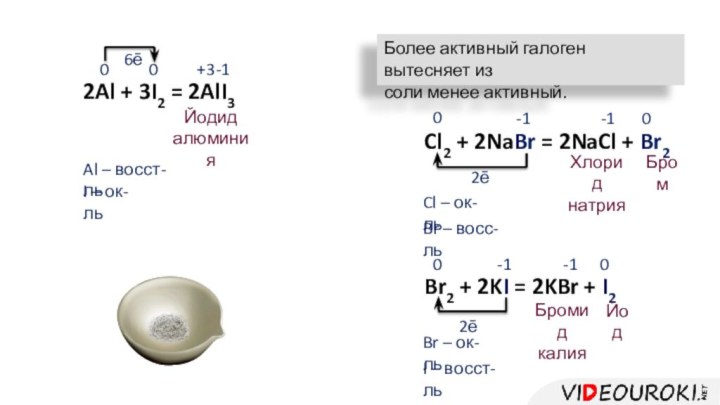
2Al + 3I2 = 2AlI3
0
0
+3
-1
Йодид
алюминия
6ē
Al – восст-ль
I –
ок-ль
Более активный галоген вытесняет из
соли менее активный.
Cl2 + 2NaBr
= 2NaCl + Br20
0
-1
-1
2ē
Хлорид
натрия
Бром
Br – восс-ль
Cl – ок-ль
Br2 + 2KI = 2KBr + I2
0
0
-1
-1
Бромид
калия
2ē
Йод
Br – ок-ль
I – восст-ль
Слайд 11
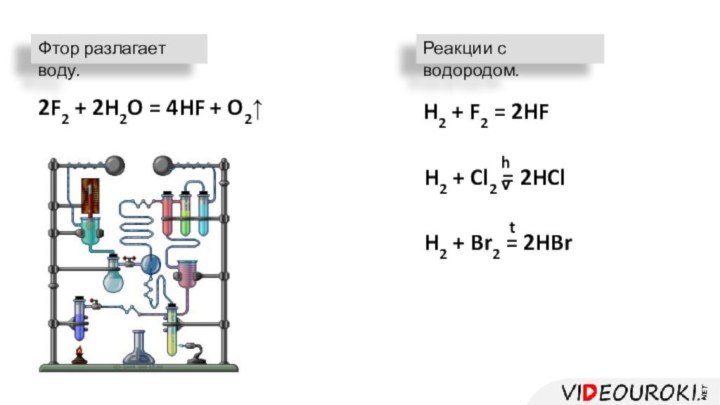
Фтор разлагает воду.
2F2 + 2H2O = 4HF +
O2↑
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2
+ Br2 = 2HBrРеакции с водородом.
hν
t
Слайд 12
F
Cl
Br
I
От греч. фторос –
«разрушающий».
Получен в 1886 году
французским химиком
А. Муссаном, который
был удостоен за это
Нобелевской премии.
От греч. хлорос –
«жёлто-зелёный».
Открыт шведским
химиком
К. Шееле в
1774 году.
От греч. бромос –
«зловонный».
Открыт в 1826 году
французским химиком
А. Баларом.
От греч. иодэс –
«фиолетовый».
Получен в 1811 году
французским
учёным Б. Куртуа
Слайд 13
Галогены – это элементы VIIA группы.
Молекулы галогенов двухатомны.
Они являются сильными окислителями, самый сильный – фтор.
Степень
окисления фтора -1, остальные галогены могут иметь степень окисления и +1, +3, +5, +7. В природе встречаются только в виде соединений.