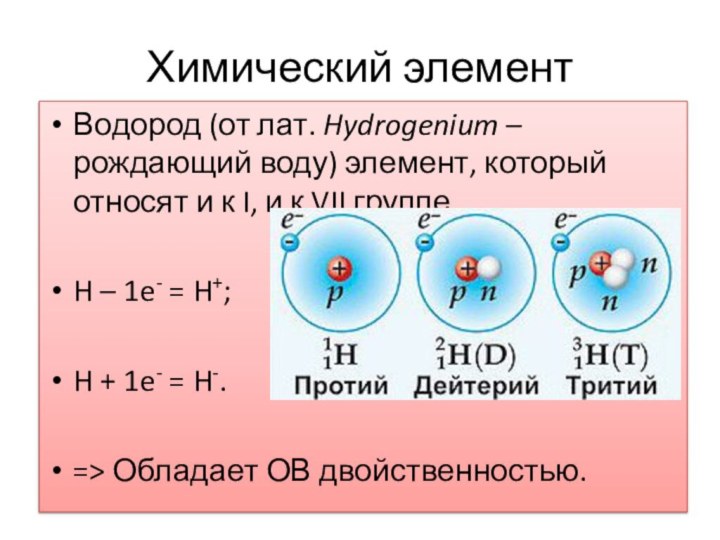
элемент, который относят и к I, и к VII
группе.H – 1e- = H+;
H + 1e- = H-.
=> Обладает ОВ двойственностью.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть








Водород – газ, без цвета и запаха, в 14,5 раз легче воздуха, горит на воздухе и взрывоопасен.
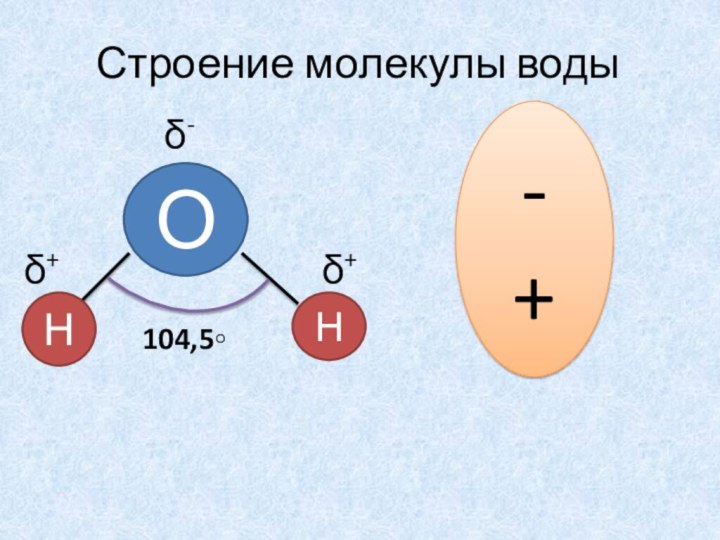
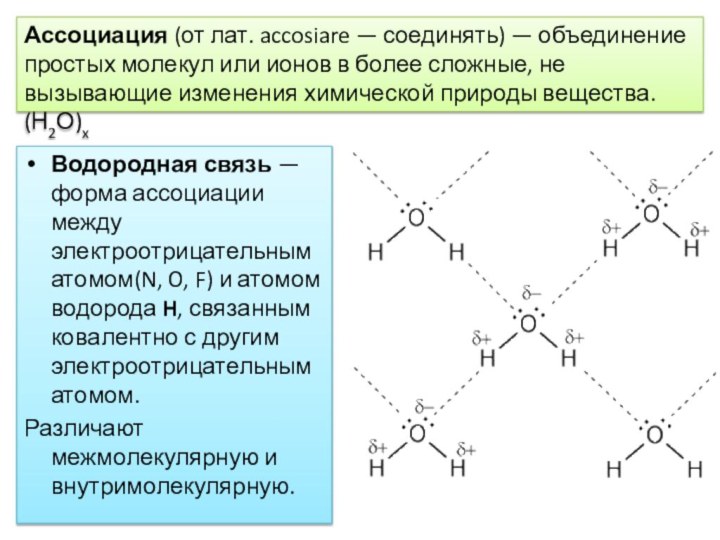
Ассоциация (от лат. accosiare — соединять) — объединение простых молекул или ионов в более сложные, не вызывающие изменения химической природы вещества. (Н2О)x