Слайд 3
«Небесный камень»
Слово «железо» произошло oт санскритских слов «джальжа»
(металл, руда) или «жель» (блистать, пылать). Люди впервые овладели
железом в четвертом-третьем тысячелетиях до н. э. Они подбирали камни, упавшие с неба -железные метеориты, и превращали их в украшения, орудия труда и охоты, которые и сейчас находят у жителей Северной и Южной Америки, Гренландии и Ближнего Востока, а также при археологических раскопках на всех континентах. Не случайно на некоторых древних языках железо именуется «небесным камнем».
Самый большой железный метеорит - Гоба весит
около 60 тонн
Слайд 4
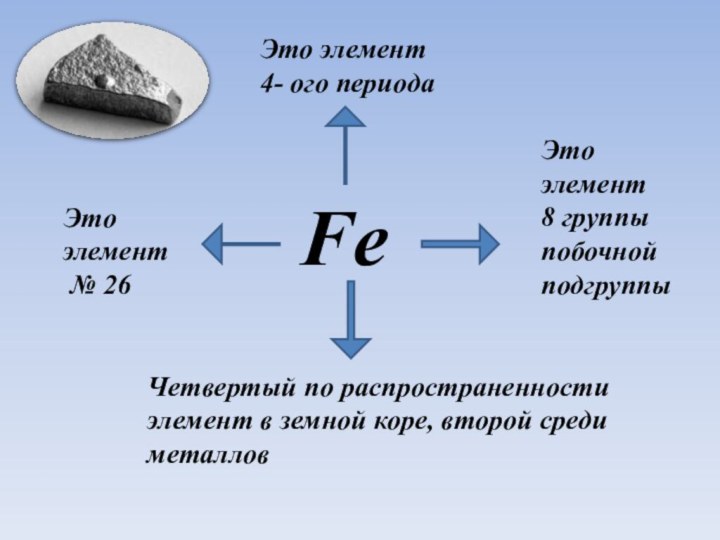
Fe
Это элемент
№ 26
Это элемент
4- ого периода
Четвертый
по распространенности элемент в земной коре, второй среди металлов
Это
элемент
8 группы
побочной подгруппы
Слайд 5
Электронное строение железа
Слайд 6
Железо – восстановитель.
Атомы Fe отдают
электроны не только с последнего уровня, приобретая С.О.+2, но
способны отдавать 1е с предпоследнего уровня, принимая при этом С.О. + 3
Слайд 7
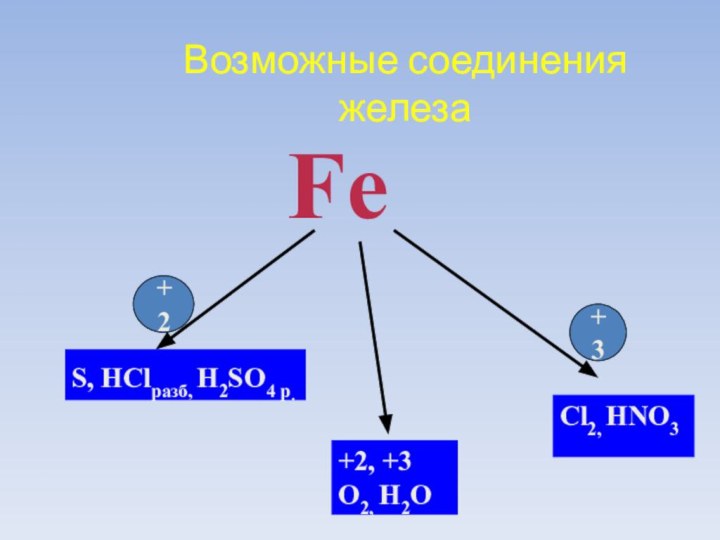
Возможные соединения
железа
Fe
S, HСlразб, H2SO4 р.
Cl2, HNO3
+2, +3
O2, H2O
+2
+3
Слайд 8
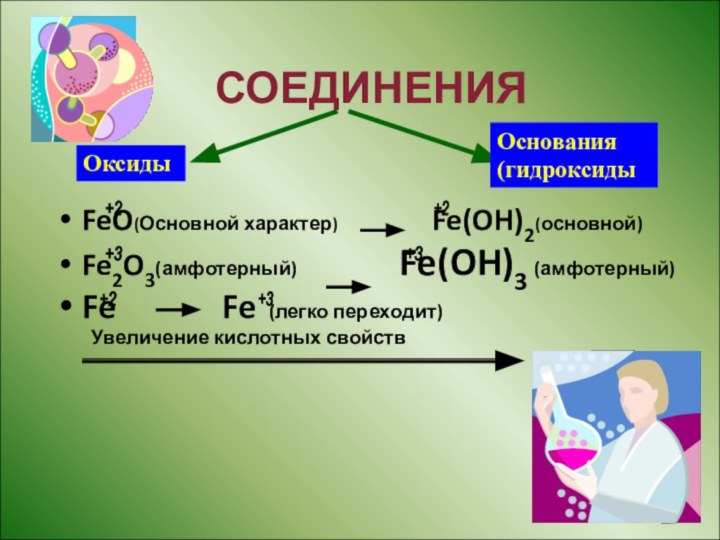
СОЕДИНЕНИЯ
FeO(Основной характер)
Fe(OH)2(основной)
Fe2O3(амфотерный) Fe(OH)3 (амфотерный)
Fe Fe (легко переходит)
Увеличение кислотных свойств
Оксиды
Основания
(гидроксиды
+2
+2
+3
+2
+3
+3
Слайд 9
Нахождение в природе
В земной коре железо распространено
достаточно широко — на его долю приходится около 4,1%
массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо.
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Слайд 10
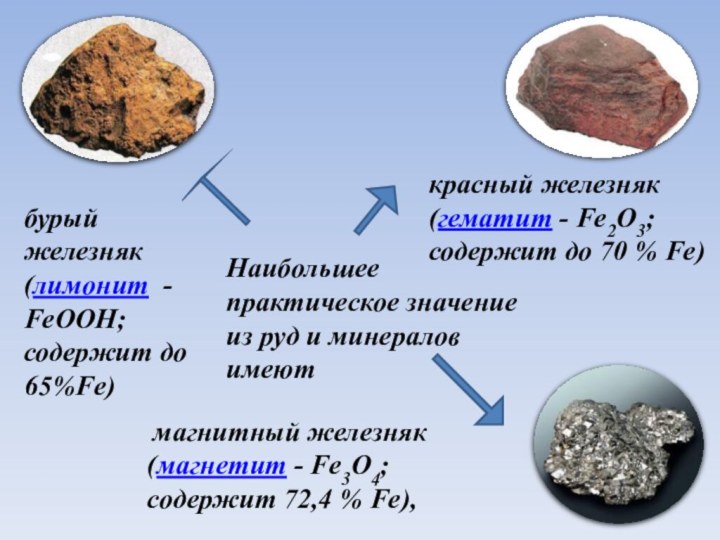
Наибольшее практическое значение из руд и минералов
имеют
магнитный железняк (магнетит - Fe3O4;
содержит 72,4 %
Fe),
бурый железняк (лимонит -
FeOOH;
содержит до 65%Fe)
красный железняк (гематит - Fe2O3; содержит до 70 % Fe)
Слайд 11
Физические свойства железа
Железо- сравнительно мягкий , ковкий серебристо-серый
металл
Температура плавления 15350C
Температура кипения 28000C
При температуре ниже 7700C
железо обладает ферромагнитными свойствами (оно легко намагничивается)
Слайд 12
Химические свойства
1. Реакции с простыми веществами
Железо сгорает в
чистом кислороде при нагревании:4Fe +3O2=2Fe2O3
Реагирует с порошком серы при
нагревании:Fe +S = FeS
Реагирует с галогенами при нагревании:2Fe + 3CL2=2FeCL3
Слайд 13
Химические свойства
2. Реакции со сложными веществами
С кислотами:
А)
с соляной кислотой
2HCL + Fe = FeCL2 + H2
Б)
с серной кислотой
H2SO4 + Fe = FeSO4 + H2
С солями:
Fe + CuSO4= Cu + FeSO4
Слайд 14
Реактивом на ионы Fe+2 являются ионы OH-
Fe
2+ 2OH- = Fe (OH)2
Реактивом на ионы Fe3+ являются
ионы OH-
Fe3+ + 3OH- = Fe(OH)3
Ещё одним реактивом на Fe 2+ и Fe3+ является KCNS роданид калия (натрия,аммония)
Слайд 15
Генетический ряд Fe+2
Fe+2 FeCl2
Fe(OH)2
FeO
Генетический ряд Fe+3
Fe+3 FeCl3 Fe(OH)3 Fe2O3
Проверь себя
Слайд 16
Проверь себя
Fe + 2HCl = FeCl2+ H2
FeCl2 +
2NaOH = Fe(OH)2 + 2NaCl
Fe(OH)2
FeO + H2O
2Fe + 3Cl2 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2Fe(OH)3 t Fe2O3 + 3H2O
Слайд 17
Железо в организме
Железо присутствует в организмах всех растений
и животных, но в малых количествах (в среднем 0,02%).
Основная биологическая функция железа – участие в транспорте кислорода и окислительных процессах. Эту функцию железо выполняет в составе сложных белков – гемопротеидов.
В организме среднего человека (масса тела 70кг) содержится 4,2 г железа, в 1л крови – 450мг.
При недостатке железа в организме развивается железистая
анемия.
Слайд 18
Биологическая роль железа
Железо играет важную роль в жизнедеятельности
живых
организмов. Оно входит в состав гемоглобина
крови человека; соединения
железа применяют для лечения анемии
Слайд 19
Тест: «Порядок ли у вас с железом».
1 Часто
ли вы чувствуете усталость или подавленность?
2. Произошли ли у
вас в последнее время изменения кожи, волос, ногтей?
3. Теряли ли вы в последнее время много крови?
4. Занимаетесь ли вы профессиональным спортом?
5. Вы редко или совсем не едите мясо?
6. Выпиваете ли вы более 3-х чашек кофе в день?
7. Вы едите мало овощей?
Слайд 20
Продукты богатые железом
• Красное мясо – говядина,
свинина, телятина, утятина;
• Говяжья, свиная, утиная печень;
•
Мясо индейки и кролика;
• Морские моллюски, съедобные устрицы, улитки;
• Яичный желток;
• Овсяная крупа из необработанного паром овса (цельная овсянка);
• Гречневая крупа, чечевица;
• Фасоль, особенно красная;
• Красная свекла;
• Горбуша, скумбрия;
• Сухофрукты (чернослив, курага, изюм, финики, яблоки, груши);
• Персики, инжир, яблоки, груши, абрикосы, слива, виноград, черешня, гранат;
• Грецкие орехи.
Слайд 21
Продукты, которые помогают усвоению железа организмом
Для нормального
усвоения железа организму необходимы витамин C и фолиевая кислота.
Поэтому желательно принимать в один прием пищи продукты, богатые железом, витамином C и фолиевой кислотой. Витамин C в большом количестве содержится в цитрусовых, киви, зеленых овощах и зелени, ягодах. Для усвоения железа полезно во время еды пить грейпфрутовый или апельсиновый сок. Фолиевая кислота – в зеленых листовых овощах.
Слайд 22
Враги Fe
Компонент чая связывают Fe в труднорастворимую форму.
Чашка чая, выпитая во время еды, сократит усвоение Fe
на 2/3.
Если чай выпить после приёма пищи, то организм не досчитается 40% Fe.
Если за 1 час до еды, то он останется в неприкосновенности.
Слайд 23
Продукты, которые препятствуют усвоению железа
Препятствуют усвоению железа
организмом молочные продукты, богатые кальцием, чай и кофе. Кальций
и железо мешают друг другу усваиваться. К примеру, если вы в один приём пищи съедите гречку с молоком, то ни железо из гречки, ни кальций из молока практически не усвоятся.
Слайд 24
Врагами являются молочные продукты и яичные желтки.
Слайд 25
Первое металлическое железо, попавшее в руки человека, имело,
вероятно, метеоритное происхождение.
Руды железа широко распространены и часто
встречаются даже на поверхности Земли
Первое железо на земле…….
Слайд 26
Люди впервые овладели железом в четвертом-третьем тысячелетиях до
н. э., подбирая упавшие с неба камни — железные
метеориты , и превращая их в украшения, орудия труда и охоты. Их и сейчас находят у жителей Северной и Южной Америки, Гренландии и Ближнего Востока, а также при археологических раскопках на всех континентах.
История получения железа
Слайд 27
Применение железа, его сплавов и соединений
Чистое железо имеет
довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов,
как катализатор химических процессов, для некоторых других целей.
Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей .