- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кислоты 9 класс, тема Теория электролитической диссоциации
Содержание
- 2. Состав кислотHxRКислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
- 3. Классификация кислотHxRодноосновные двухосновные трехосновные HCl;
- 4. Кислоты – электролитыКислоты – электролиты, при диссоциации
- 5. Изменение окраски индикаторовЛакмус + H розовыйМетилоранж + H красный++
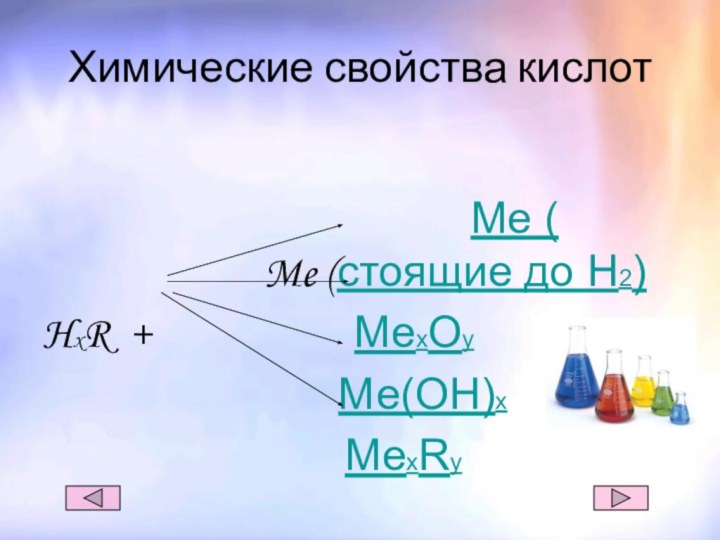
- 6. Химические свойства кислот
- 7. Взаимодействие кислот с Металлами2HCl + Zn
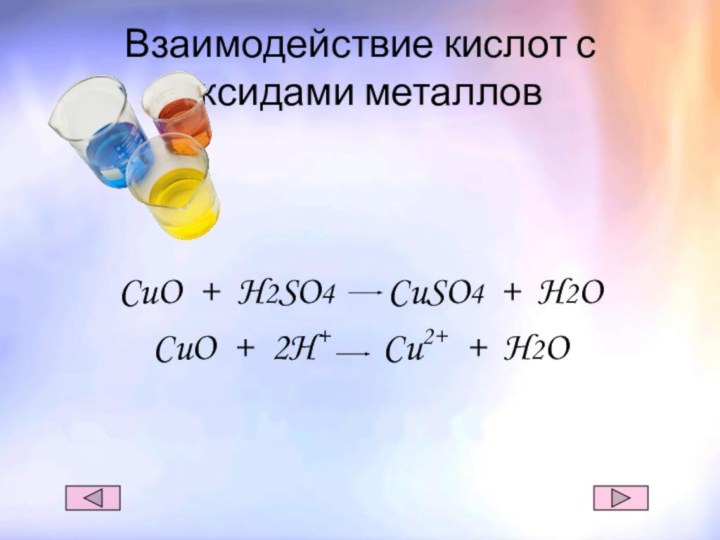
- 8. Взаимодействие кислот с оксидами металловCuO + H2SO4
- 9. Взаимодействие с основаниями (реакция нейтрализации)Ca(OH)2 +
- 10. Взаимодействие с солями Реакция идет, если выделяется
- 11. Получение кислотБескислородные:H2 + Cl2 = 2HClH2 +
- 12. Специфические свойства кислотКонцентрированные HNO3, H2SO4
- 13. Проверь себя!Напишите уравнения реакций, которые осуществимы.Na +
- 14. Скачать презентацию
- 15. Похожие презентации
Состав кислотHxRКислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.












Слайд 2
Состав кислот
HxR
Кислоты – сложные вещества, состоящие из атомов
водорода, способных замещаться на металл, и кислотного остатка.
Слайд 3
Классификация кислот
HxR
одноосновные двухосновные трехосновные
HCl;
HNO3; H2SO4; H2CO3;
H3PO4; H3BO3HBr H2S
кислородосодержащие бескислородные
H2SO4; HNO3; H2SiO3; H2S; HCl; HF
Слайд 4
Кислоты – электролиты
Кислоты – электролиты, при диссоциации которых
в качестве катиона образуется катион H.
HCl H
+ ClH2SO4 Н + HSO4
HSO4 H + SO4
H3PO4 3H + PO4
+
+
-
+
-
-
+
2-
+
3-
Слайд 7
Взаимодействие кислот с Металлами
2HCl + Zn
ZnCl2 + H2
2H + + Zn0
Zn2+ + H202Al + 3H2SO4 Al2(SO4)3 + 3H2
Слайд 9
Взаимодействие с основаниями (реакция нейтрализации)
Ca(OH)2 + 2HNO3
= Ca(NO3)2 + 2H2O
OH- + H+ = H2O
Fe(OH)3 +
3HCl = FeCl3 + 3H2O
Слайд 10
Взаимодействие с солями
Реакция идет, если выделяется газ
или выпадает осадок
Na2CO3 + 2HCl = 2NaCl +
H2O + CO2CO32- + 2H+ = H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba2+ + SO42- = BaSO4
Слайд 11
Получение кислот
Бескислородные:
H2 + Cl2 = 2HCl
H2 + S
= H2S
Кислородосодержащие:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O =
H2SO4
Слайд 12
Специфические свойства кислот
Концентрированные HNO3, H2SO4
при взаимодействии с металлами не выделяют H2.
Cu + 2H2SO4
(конц.) = CuSO4 + SO2 + 2H2OPb + 4HNO3 (конц.) = Pb(NO3)2 + 2NO2 + 2H2O
Слайд 13
Проверь себя!
Напишите уравнения реакций, которые осуществимы.
Na + HCl
Ca
+ H3PO4
Al+ H2SO4
MgO + H2SO4
NaCl + HCl
Fe(OH)3 + HNO3
Fe2O3
+ H2SO4Li2O + H3PO4
Cu + HCl
Na2CO3 + HCl





























