с обучающей программой «Основные классы неорганических веществ».
Программа содержит информацию
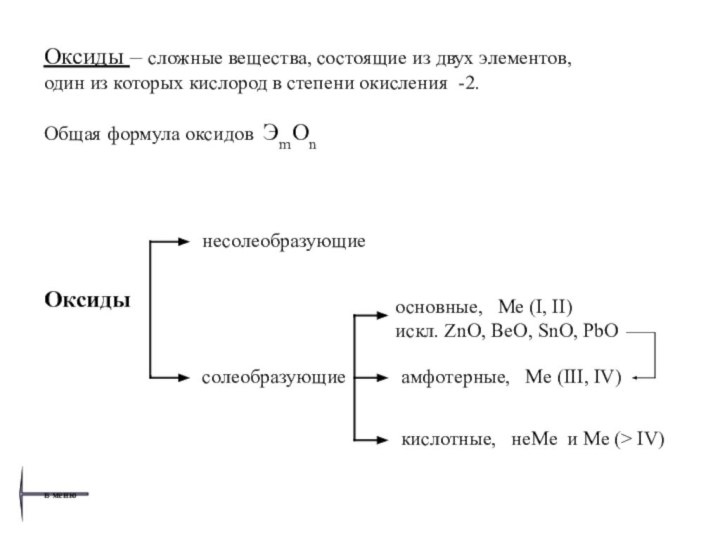
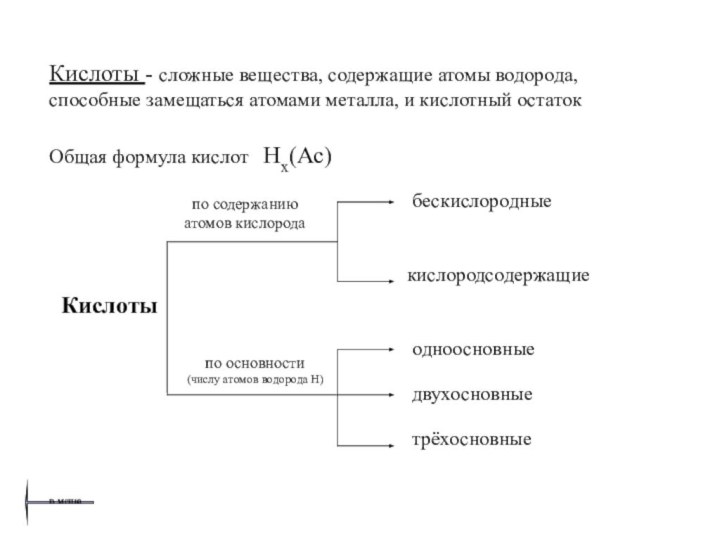
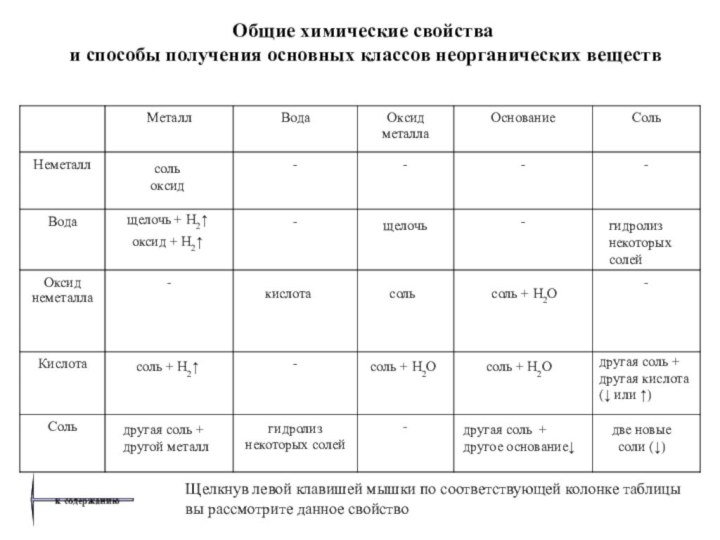
о классификации, общих химических свойствах и способах получения основных классов неорганических веществ.
Программа составлена с использованием гиперссылок, позволяющих перейти
к странице с нужной информацией. Использование гиперссылок в каждой колонке
обобщающей таблицы позволяет изучить каждое химическое свойство веществ:
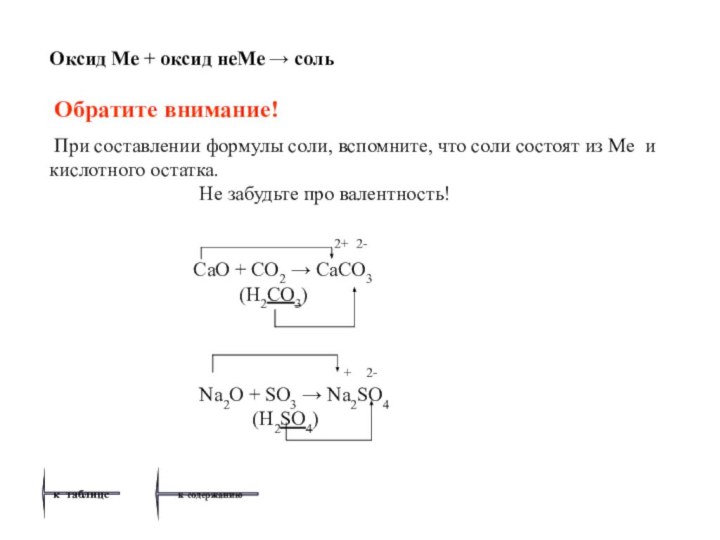
нажатием левой клавиши мышки, вы легко перейдете к странице, где даны необходимые пояснения, приведены примеры уравнений химических реакций.
Для проверки, как вы усвоили данную тему, пройдите тестирование. Если вы не верно отвечаете на вопрос теста, программа дает возможность еще раз повторить учебный материал.
Успехов! И надеюсь, что эта программа поможет вам в изучении данной темы.
Автор программы: Ростовцева Л.В.