— это условный заряд атомов химического элемента в соединении,
если предположить, что вещество состоит только из простых ионов.-3
0
+1
+2
+3
+4
+5
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть
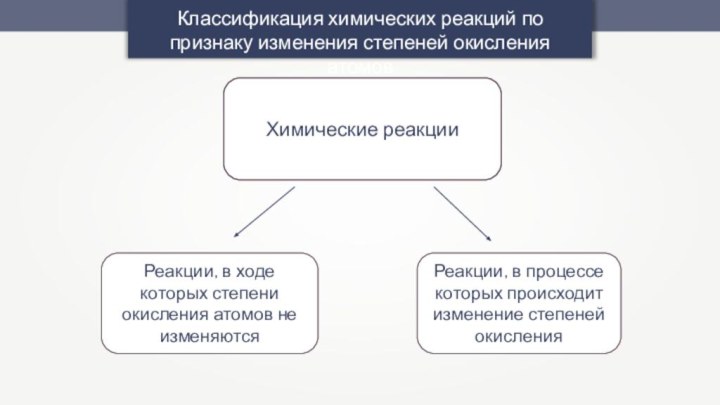

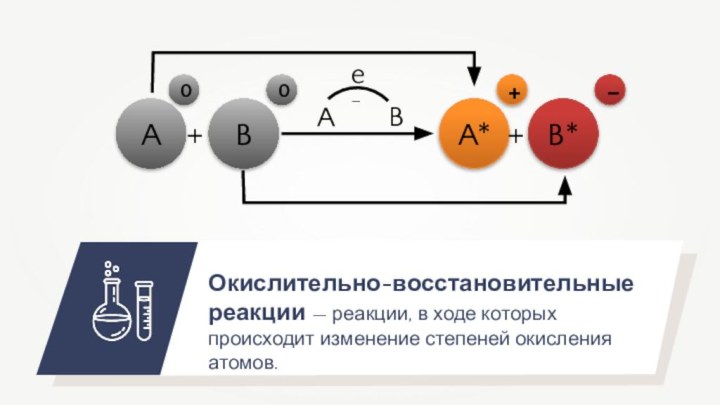



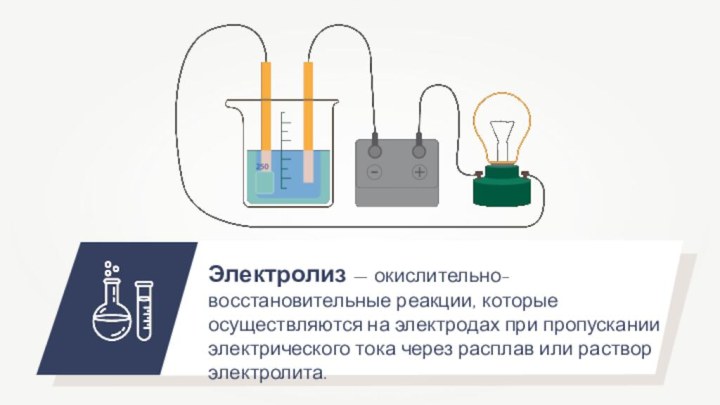
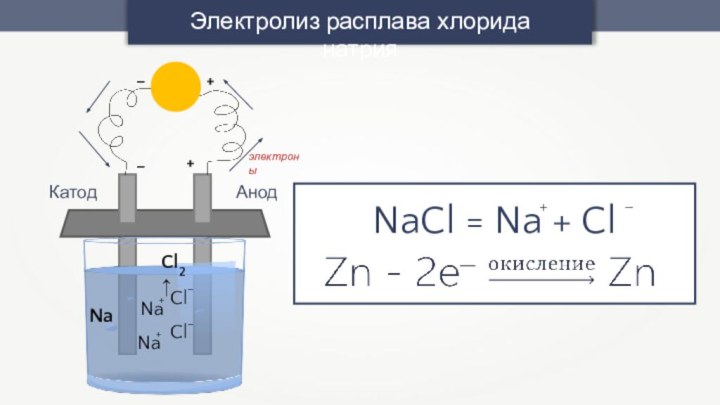
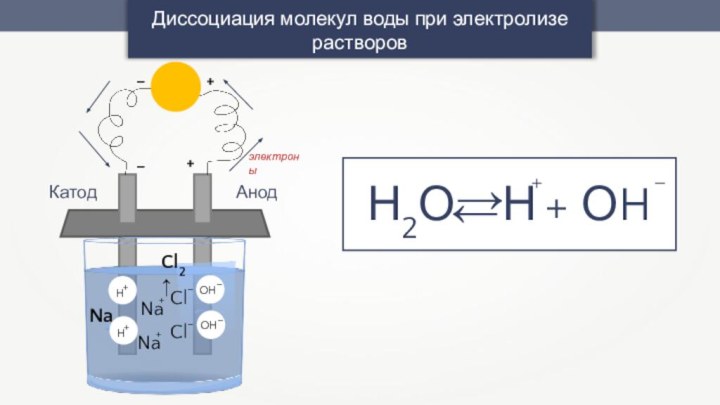




-3
0
+1
+2
+3
+4
+5