Слайд 2
Строение ацетилена —
Строение
молекулы
ацетилена.
Общая формула – Сn Н2n-2
Молекулярная
формула -C2H2
Ацетилен -- ненасыщенный углеводород.
Имеет тройную связь между атомамиИмеет тройную связь между атомами углерода.
Принадлежит к классу-алкинов .
Слайд 3
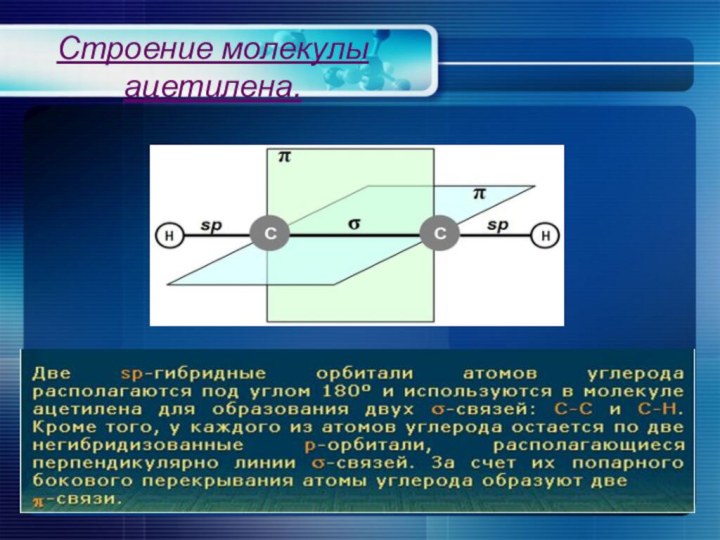
Строение молекулы ацетилена.
Слайд 4
Углеродные атомы в молекуле ацетилена находятся в
состоянии sp-гибридизации.
Молекула ацетилена линейная; все 4 атома
расположены на прямой.
Энергия тройной связи 836 кДж/моль.
Расстояние С ≡ С и С-Н равно соответствию 0,1205 и 0,1059 нм.
Слайд 5
История
Ацетилен открыт в 1836Ацетилен открыт в 1836 г. Э.

ДэвиАцетилен открыт в 1836 г. Э. Дэви, синтезирован из угляАцетилен
открыт в 1836 г. Э. Дэви, синтезирован из угля и водородаАцетилен открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродамиАцетилен открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. БертлоАцетилен открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Название этого соединения уже более ста лет знакомо не только химикам. С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (СаС2 + 2Н2О ® С2Н2 + Са(ОН)2), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени – от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Слайд 6
Получение ацетилена.
В промышленности ацетилен получают
действием воды на карбид кальция:
Слайд 7
Физические свойства
При нормальных условиях — бесцветный
газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C.
При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2H2 есть на Уране и Нептуне.
Слайд 8
Химические свойства
1. Присоединения:
HC≡CH
+ Cl2 -> СlСН=СНСl
2. Гидрирование ацетилена в присутствии катализатора
и 25 °C. :
HC≡CH + Н2 -> Н2С=СН2 (этилен)
Н2С=СН2+Н2 -> СН3-Н3С (этан)
Гидратация ацетилена:
(реакция Кучерова)
Слайд 9
Михаил Григорьевич КУЧЕРОВ
3 июня 1850 г. – 26

июня 1911 г
Михаил Григорьевич Кучеров – русский химик-органик.
Родился в имении отца под Полтавой. Окончил Петербургский земледельческий институт (1871). До 1910 г. работал в том же институте (с 1877 – Лесной институт), с 1902 г. – профессор.
Основные работы посвящены органическому синтезу. Получил (1873) дифенил и некоторые его производные. Исследовал (1875) условия превращения бромвинила в ацетилен. Открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонильных соединений, в частности, превращения ацетилена в ацетальдегид в присутствии солей ртути (реакция Кучерова). За это открытие был удостоен (1885) премии Русского физико-химического общества. Реакция Кучерова была положена в основу промышленного способа получения ацетальдегида и уксусной кислоты. Показал (1909), что гидратацию ацетиленовых углеводородов можно проводить в присутствии солей магния, цинка, кадмия. Исследовал механизм этой реакции. Установил промежуточное образование металлорганических комплексов за счёт неполновалентного взаимодействия атомов металла соли и углеродных атомов с тройной связью.
Слайд 11
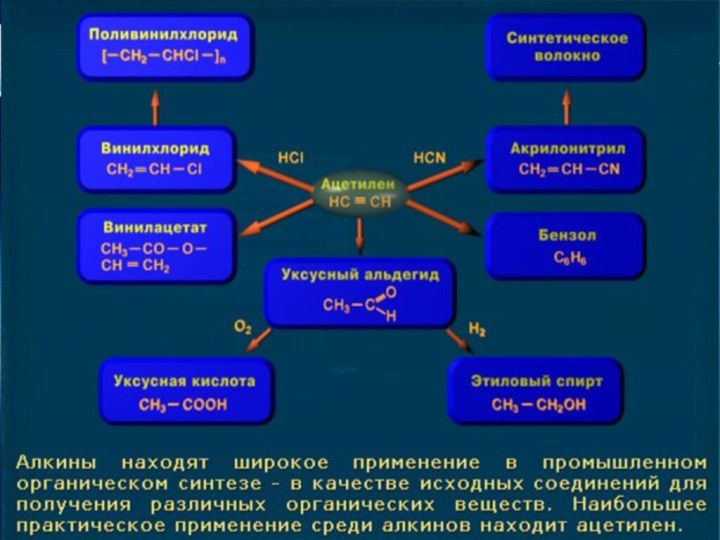
Применение
Ацетилен используют:
для сваркидля сварки и резки
металлов,
как источник очень яркого, белого света в автономных
светильниках, где он получается реакцией карбида кальция и воды,
в производстве взрывчатых веществ,
для получения уксусной кислотыдля получения уксусной кислоты, этилового спиртадля получения уксусной кислоты, этилового спирта, растворителейдля получения уксусной кислоты, этилового спирта, растворителей, пластических массдля получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучукадля получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов