- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Скорость химической реакции (9 класс)
Содержание
- 2. Основные понятия темыСкорость химических реакций.Катализатор.Закон действующих масс.Гомогенная и гетерогенная система.
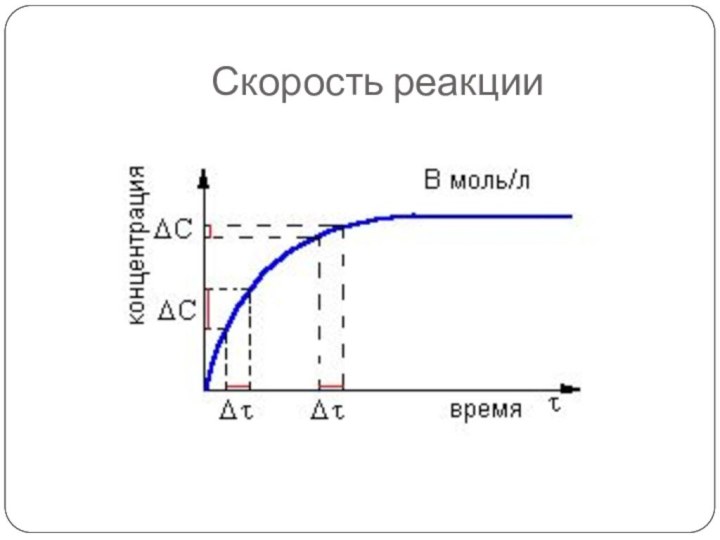
- 3. Скорость реакции
- 5. Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
- 6. Факторы, влияющие на скорость реакцииПрирода реагирующих веществ;Концентрация реагирующих веществ;Площадь соприкосновения (для твердых веществ)ТемператураНаличие катализатора или ингибитора
- 7. Гомогенная реакцияРеакции, которые протекают в однородной среде, например, в смеси газов или в растворе, называют гомогенными.
- 8. Гетерогенная реакцияГетерогенные - это такие реакции, которые идут
- 9. Примеры гомо- и гетерогенных реакций
- 10. Влияние температуры на константу скорости реакцииКонстанта скорости
- 11. При повышении температуры на каждые 10 градусов
- 12. Задача 1Как необходимо изменить температуру в системе,
- 13. Задача 2Во сколько раз уменьшится скорость реакции
- 14. Задача 3Температурный коэффициент некоторой химической реакции равен
- 15. Закон действующих масс (Гульберта и Ваааге)Скорость
- 16. Задача 4Напишите уравнение закона действующих масс для
- 17. Понятие о катализаторахКатализатор - это (от греч.
- 18. Домашнее задание§ 5Написать уравнения закона действующих масс
- 19. Скачать презентацию
- 20. Похожие презентации
Основные понятия темыСкорость химических реакций.Катализатор.Закон действующих масс.Гомогенная и гетерогенная система.


















Слайд 2
Основные понятия темы
Скорость химических реакций.
Катализатор.
Закон действующих масс.
Гомогенная и
гетерогенная система.
Слайд 5 Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или
продукта в единицу времени.
Слайд 6
Факторы, влияющие на скорость реакции
Природа реагирующих веществ;
Концентрация реагирующих
веществ;
Площадь соприкосновения (для твердых веществ)
Температура
Наличие катализатора или ингибитора
Слайд 7
Гомогенная реакция
Реакции, которые протекают в однородной среде, например,
в смеси газов или в растворе, называют гомогенными.
Слайд 8
Гетерогенная реакция
Гетерогенные - это такие реакции, которые идут на
поверхности соприкосновения твердого вещества и газа, твердого вещества и
жидкости и т. д.
Слайд 10
Влияние температуры на константу скорости реакции
Константа скорости реакции
есть функция от температуры; повышение температуры, как правило, увеличивает
константу скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее эмпирическое правило:Слайд 11 При повышении температуры на каждые 10 градусов константа
скорости элементарной химической реакции увеличивается в 2 – 4
раза.Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ. Математически правило Вант-Гоффа можно записать следующим образом:
Слайд 12
Задача 1
Как необходимо изменить температуру в системе, чтобы
скорость химической реакции увеличить в 81 раз. Температурный коэффициент
равен 3?
Слайд 13
Задача 2
Во сколько раз уменьшится скорость реакции при
понижении температуры газовой смеси со 120 °C до 80
°C, если температурный коэффициент равен 3?
Слайд 14
Задача 3
Температурный коэффициент некоторой химической реакции равен 4.
Как изменится скорость этой химической реакции при нагревании реакционной
смеси от 20 до 50 градусов?
Слайд 15
Закон действующих масс (Гульберта и Ваааге)
Скорость химической реакции
в каждый момент времени пропорциональна концентрациям реагентов, возведенным в
некоторые степени:v = k[A]n[B]m,
для реакции aA + bB = ...