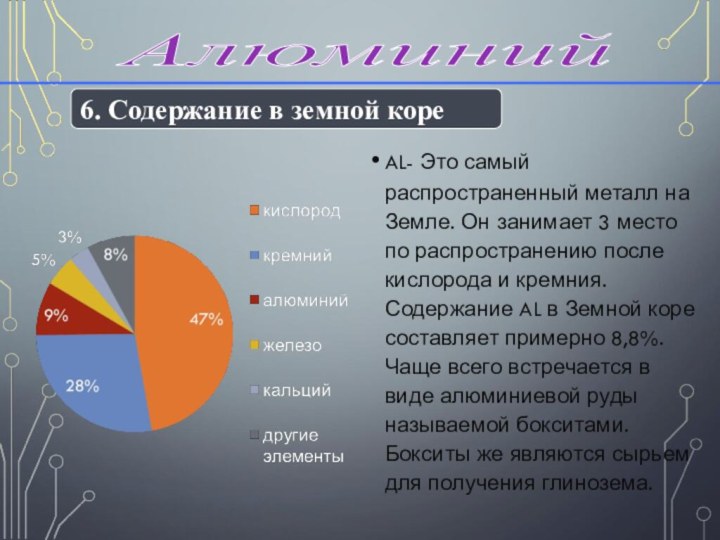
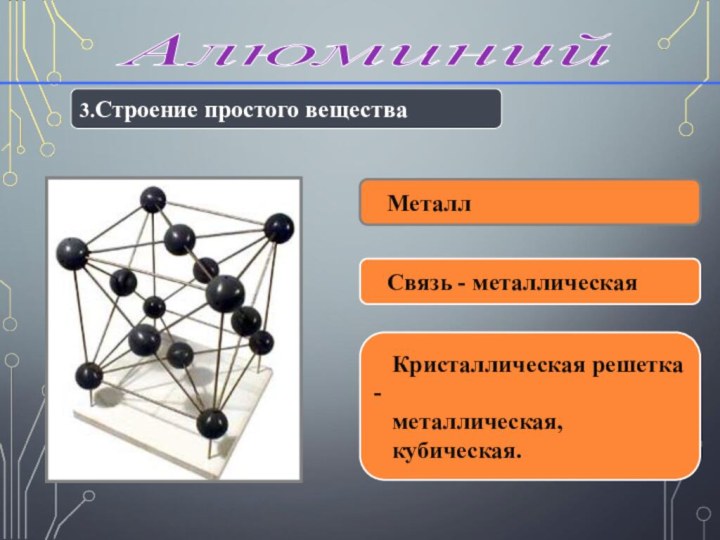
датским физиком Эрстедом Х.
в 1825 г. Название элемента
происходит от лат.алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей.
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом: