Слайд 2
Азот – простое вещество
N2 – бесцветный газ
без запаха и вкуса, легче воздуха, плохо растворяется в
воде, входит в состав воздуха (78% по объему). N Ξ N прочная молекула, хим. инертность.
Нахождение в природе. Входит в состав воздуха.
В виде нитратов содержится в почве. Является составной частью биологических вещ-в.
Химические свойства. В обычных условиях малоактивен. При высоких температурах становится реакционноспособным.
С кислородом.
С водородом.
С Ме.
Слайд 3
Аммиак NH3.
В молекуле NH3 три ковалентной связи. У
азота
осталась собственная пара электронов. Между
молекулами аммиака возникает водородная связь
(см.
стр.112)
Физ. свойства. Бесцветный газ с резким запахом, в 2
раза легче воздуха, ядовит. Хорошо растворяется в
воде ( в 1 Vводы растворяется 720 V NH3 ). Водный
раствор аммиака – аммиачная вода, или нашатырный
спирт.
NH3 + H2O → NH3 · H2O (NH4OH)
Щелочной раствор аммиака, наличие гидроксильной группы (OH-).
Слайд 4
Химические свойства аммиака.
NH3 активное вещество.
Взаимодействует :
С водой, с
кислотами.
NH3 + HCI → NH4CI
NH4+ – ион
(катион) аммония.
Донорно-акцепторный механизм.
Донор электронов N в аммиаке, а акцептором –
катион водорода H+.
Аммиак сильный восстановитель, поэтому
может окисляться.
4NH3+3O2→2N2+6H2O 4NH3+ 5O2катал.→4NO + 6H2O
Слайд 5
Получение аммиака.
1. В промышленности из азота и
водорода.
N2 + 3H2 ↔ 2NH3
2. В лаборатории.
Из
солей аммония со щелочами при нагревании.
2NH4CI + Ca(OH)2 →CaCI2 + 2NH3↑ + 2H2O
Применение. См. стр. 115
Д/з: §23, 24. стр. 116 № 4,5.
Слайд 6
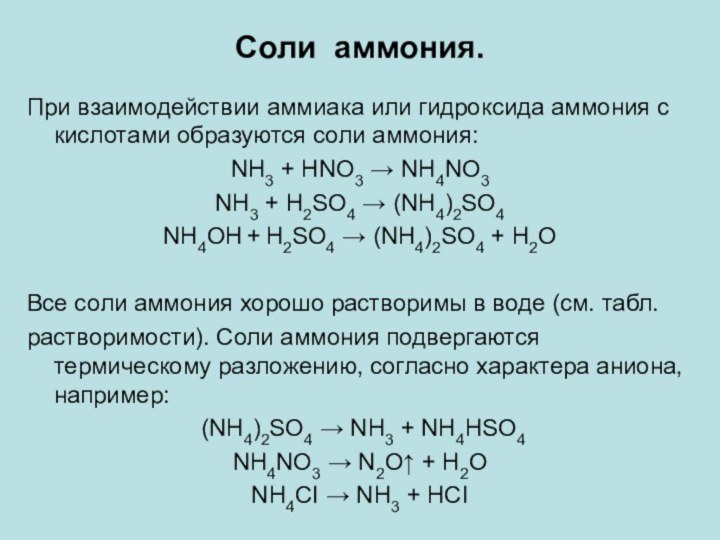
Соли аммония.
При взаимодействии аммиака или гидроксида аммония с
кислотами образуются соли аммония:
NH3 + HNO3 → NH4NO3
NH3 +
H2SO4 → (NH4)2SO4
NH4OH + H2SO4 → (NH4)2SO4 + H2O
Все соли аммония хорошо растворимы в воде (см. табл.
растворимости). Соли аммония подвергаются термическому разложению, согласно характера аниона, например:
(NH4)2SO4 → NH3 + NH4НSO4
NH4NO3 → N2O↑ + H2O
NH4CI → NH3 + HCI
Слайд 7
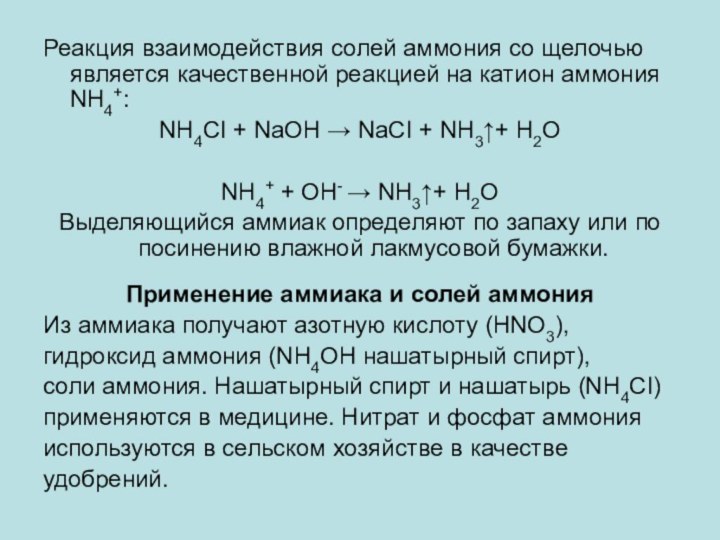
Реакция взаимодействия солей аммония со щелочью является качественной
реакцией на катион аммония NH4+:
NH4СI + NaOH → NaCI
+ NH3↑+ H2O
NH4+ + OH- → NH3↑+ H2O
Выделяющийся аммиак определяют по запаху или по посинению влажной лакмусовой бумажки.
Применение аммиака и солей аммония
Из аммиака получают азотную кислоту (HNO3),
гидроксид аммония (NH4OH нашатырный спирт),
соли аммония. Нашатырный спирт и нашатырь (NH4СI)
применяются в медицине. Нитрат и фосфат аммония
используются в сельском хозяйстве в качестве
удобрений.
Слайд 8
Оксиды азота. Азотная кислота.
Несолеобразующие
и солеобразующие оксиды:
N2O –
оксид азота (I) N2O3 – оксид азота (III)
NO – оксид азота (II) NO2 – оксид азота (IV)
N2O4– димер оксид азота (IV)
N2O5 – оксид азота (V)
Oксид азота (I) N2O – бесцв.газ со слабым запахом, сладков. вкусом,
хорошо раствр. в воде, но реагирует с ней.
Оксид азота (II) NO – бесцв.газ, без запаха, малораствор., легко окисляется на воздухе до оксида азота (IV)
Оксид азота (IV) NO2 – ядовитый газ бурого цвета, с запахом, хорошо растворим в воде.
Оксид азота (III) N2O3 – темно-синяя жидкость, взаимодействует с водой, образует азотистую кислоту.
Оксид азота (V) N2O5 – бесцв. кристаллы, хорошо растворяются в воде с образованием азотной кислоты.
Слайд 9
Азотная кислота HNO3
Физ.св-ва: HNO3 – бесцв.жидкость, с резким
запахом, легко испаряется. При попадании на кожу вызывает сильные
ожоги, желтого цвета, 63%, с водой смешивается в любых соотношениях, разлагается на свету:
HNO3 → H2O + NO2↑+ O2↑
Хим. св-ва: HNO3 – наиболее сильная кислота, полностью
диссоциирует на ионы.
Реагирует: с основными оксидами, с основаниями, солями слабых кислот.
HNO3 – сильнейший окислитель.
С Ме никогда не выделяется H2. См.таблицу