- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрический ток в различных средах
Содержание
- 2. Краткий план презентации:Майкл Фарадей(создатель закона электролиза)Закон электролиза
- 3. Майкл ФарадейФАРАДЕЙ, МАЙКЛ (Faraday, Michael) (1791-1867), английский
- 4. Закон электролизаПрохождение электрического тока через раствор или
- 5. То есть масса каждого из веществ, выделяющихся
- 6. Рассмотрим одно из применений электролиза в технике
- 7. Разберемся, почему чистая медь откладывается именно на
- 8. Скачать презентацию
- 9. Похожие презентации







Слайд 4
Закон электролиза
Прохождение электрического тока через раствор или расплав
электролита вызывает на поверхности обоих электродов химические реакции, приводящие
к образованию новых веществ. Например, используя угольные электроды, при электролизе водного раствора хлороводорода мы получим водород и кислород, а при электролизе медного купороса – медь и кислород.Опыты показывают, что масса веществ, выделяющихся на электродах, зависит от рода образующихся веществ, силы тока и времени его пропускания. Математически это записывается так:
Вспомним, что при изучении силы тока мы привели формулу для ее вычисления. Выразив из этой формулы заряд, получим: q=It. Используя это равенство, мы можем записать:
Слайд 5 То есть масса каждого из веществ, выделяющихся в
процессе электролиза, прямо пропорциональна заряду, прошедшему через электролит. Так
формулируется первый закон Фарадея.Коэффициент пропорциональности k называют электрохимическим эквивалентом вещества. Он различен для различных веществ. Например, для водорода k = 0.34 мг/Кл. Это значит, что при пропускании 1 кулона электричества* через раствор хлороводорода выделится 0.34 мг водорода.
Электрохимические эквиваленты веществ, мг/Кл
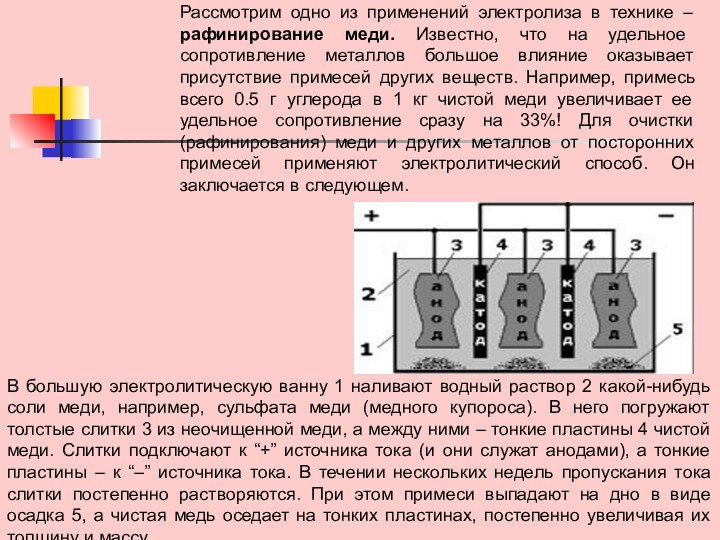
Слайд 6 Рассмотрим одно из применений электролиза в технике –
рафинирование меди. Известно, что на удельное сопротивление металлов большое
влияние оказывает присутствие примесей других веществ. Например, примесь всего 0.5 г углерода в 1 кг чистой меди увеличивает ее удельное сопротивление сразу на 33%! Для очистки (рафинирования) меди и других металлов от посторонних примесей применяют электролитический способ. Он заключается в следующем.
В большую электролитическую ванну 1 наливают водный раствор 2 какой-нибудь соли меди, например, сульфата меди (медного купороса). В него погружают толстые слитки 3 из неочищенной меди, а между ними – тонкие пластины 4 чистой меди. Слитки подключают к “+” источника тока (и они служат анодами), а тонкие пластины – к “–” источника тока. В течении нескольких недель пропускания тока слитки постепенно растворяются. При этом примеси выпадают на дно в виде осадка 5, а чистая медь оседает на тонких пластинах, постепенно увеличивая их толщину и массу.
Слайд 7 Разберемся, почему чистая медь откладывается именно на катодах
(отрицательных электродах). Вы помните, что в водном растворе медного
купороса (CuSO4) его молекулы существуют в виде ионов: (Cu)2+ и (S04)2–. Поскольку ионы меди заряжены положительно, то при включении тока они начнут двигаться к “–” электроду .Достигнув его, ионы медиполучают по два электрона и превращаются в нейтральные атомы. Перестав быть заряженными частицами, атомы меди прекращают свое движение и оседают на катоде, увеличивая его массу.
Электролиз – это сложное физико-химическое явление. Как вы только что узнали, электролиз водного раствора медного купороса при использовании медных электродов приводит к переносу меди с анода на катод. Но, если же вместо медных электродов использовать угольные или графитовые, то на катоде будет по-прежнему выделяться медь, а на аноде – кислород. Кроме того, раствор медного купороса будет постепенно превращаться в раствор серной кислоты. Все эти явления изучает наука электрохимия.