- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Будова атома. Закріпити знання про будову атома. Узагальнити знання про стан електронів у атомі
Содержание
- 2. Будова атомаАтом – позитивно заряджене ядро і
- 3. число р+ = число е- = порядковий
- 4. Ar = Z + NПорядковий номер –
- 5. Електрони у атомі роташовані на енергетичних рівнях
- 6. Електрони з однаковою формою електронної хмари утворюють
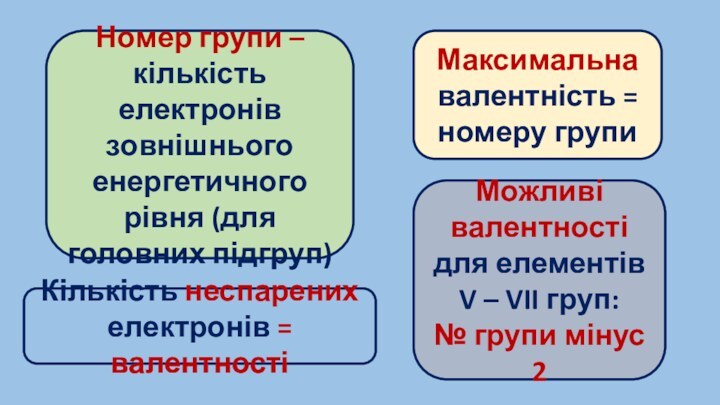
- 7. 1 період – 2 е2 період –
- 8. Залежно від того, який підрівень заповнюється останнім,
- 9. Скачать презентацию
- 10. Похожие презентации
Будова атомаАтом – позитивно заряджене ядро і негативно заряджені електрони Атом - найменша, електронейтральна, хімічно неподільна частинка речовини








Слайд 4
Ar = Z + N
Порядковий номер –
протонне
число Z –
заряд ядра атома
Нуклонне число – сума
протонів Z і нейтронів N (= маса атома)
Кількість нейтронів = маса атома мінус порядковий номер
Хімічний елемент – вид атомів з однаковим зарядом ядра
протонним числом
Слайд 5 Електрони у атомі роташовані на енергетичних рівнях (енергетичних
шарах),
кількість яких = номеру періода
Електрони відрізняться формою
електронної хмари (орбіталі)S ) ) )
Слайд 6 Електрони з однаковою формою електронної хмари утворюють енергетичні
підрівні
s, p, d, f
Електрони розташовуються у атомі
згідно принципу найменшої енергії Е
Слайд 7
1 період – 2 е
2 період – 8
е
3 період – 18 е
Пригадати «спарені і неспарені
електрони»Енергетична комірка вміщує
2 електрони з протилежними спінами
Слайд 8 Залежно від того, який підрівень заповнюється останнім, розрізняють
s, p, d – елементи
(d – елементи –
елементи побічних підгруп)Хімічні елементи однієї підгрупи мають однакову будову зовнішнього
Е-рівня, тому
подібні хімічні властивості





























