- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по физике на тему: Основные положения МКТ
Содержание
- 2. Цели урока:Определить основные положения МКТ и их
- 3. Исторический факт Примерно в IV–
- 4. Основные положения молекулярно – кинетической теории (МКТ)Вещество
- 5. Строение вещества Молекулы
- 6. АтомыАтом— это электрически нейтральная микрочастица, состоящая из
- 7. М.В.Ломоносов Роберт Броун Жан Батист Перрен
- 8. Броуновское движениеЭто тепловое движение мельчайших микроскопических частиц,
- 9. ДиффузияДиффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
- 10. Физические величины, характеризующие молекулы:Относительная молекулярная массаКоличество веществаМолярная масса
- 11. 1. Относительная молекулярная масса Относительной молекулярной (или
- 12. 2. Количество вещества Количество вещества – это
- 13. 3. Молярная масса Молярная масса М –
- 14. Скачать презентацию
- 15. Похожие презентации










Слайд 3
Исторический факт
Примерно
в IV– Vв
д.н.э
древние греки предположили ,что окружающий мир состоит
из маленьких частиц ,которые нельзя разделить на более мелкие они назвали их атомами ( неделимые)
Слайд 4
Основные положения молекулярно – кинетической теории (МКТ)
Вещество состоит
из частиц
Все частицы беспорядочно движутся
Частицы взаимодействуют друг с другом
Слайд 5
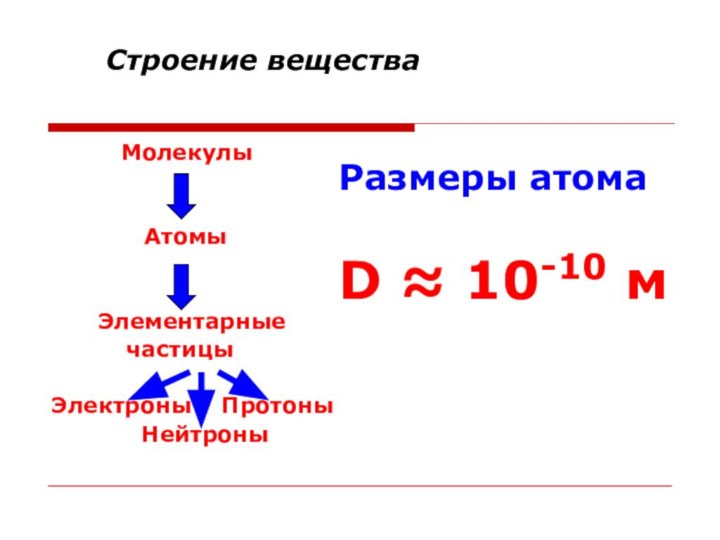
Строение вещества
Молекулы
Атомы
Элементарные
частицыЭлектроны Протоны
Нейтроны
Размеры атома
D ≈ 10-10 м
Слайд 6
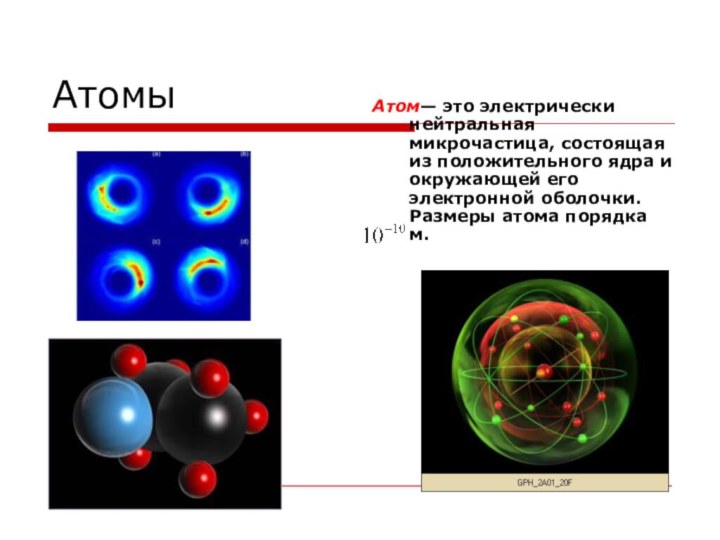
Атомы
Атом— это электрически нейтральная микрочастица, состоящая из положительного
ядра и окружающей его электронной оболочки. Размеры атома порядка
м.
Слайд 8
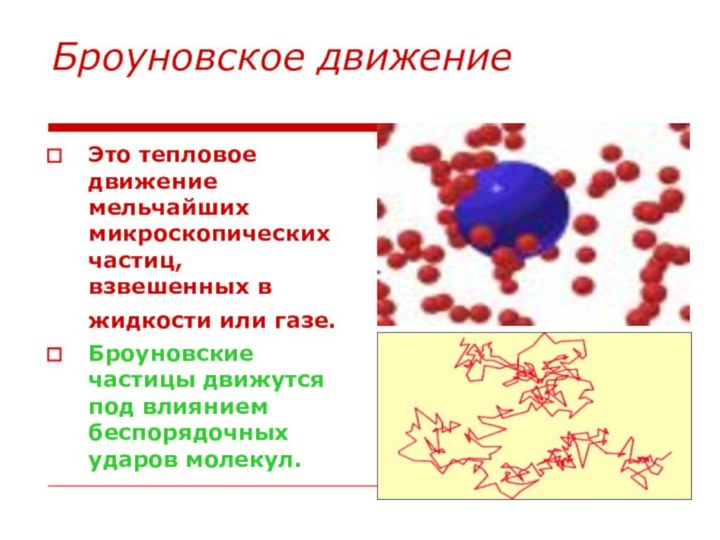
Броуновское движение
Это тепловое движение мельчайших микроскопических частиц, взвешенных
в жидкости или газе.
Броуновские частицы движутся под влиянием
беспорядочных ударов молекул.
Слайд 9
Диффузия
Диффузией называется явление проникновения двух или нескольких соприкасающихся
веществ друг в друга.
Слайд 10
Физические величины, характеризующие молекулы:
Относительная молекулярная масса
Количество вещества
Молярная масса
Слайд 11
1. Относительная молекулярная масса
Относительной молекулярной (или атомной) массой
вещества Мr называют отношение массы молекулы (или атома) mo
данного вещества к 1/12 массы атома углерода moc:Относительные молекулярные массы определяют по таблице Менделеева.
Например:
Мr(CO2) = 12 + 2 ∙ 16 = 44
Мr(Н2О) = 2 ∙ 1 + 16 = 18
Слайд 12
2. Количество вещества
Количество вещества
– это физическая величина
равная отношению числа молекул N в данном теле к
постоянной Авогадро NА, т.е. к числу молекул в 1 моль вещества:Единица количества вещества – 1 моль.
Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в 12 г углерода.
Постоянная Авогадро – число атомов в 1 моль вещества или в 12 г углерода:
NA ≈ 6 ∙ 1023 моль-1
Слайд 13
3. Молярная масса
Молярная масса М –
это масса вещества, взятого в количестве 1 моль.
Молярная масса
равна произведению массы молекулы на постоянную Авогадро:Единица измерения молярной массы в “СИ” – кг/моль.
Связь молярной массы с молекулярной:
М = 10-3 Мr кг/моль
Например:
М(CO2) = 44∙10-3 кг/моль.
М(Н2О) = 18 ∙10-3 кг/моль.