- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Атомның құрылысы. Резерфорд тәжірибесі
Содержание
- 2. ХІХ ғасырдың аяғына дейін атом бөлінбейді деген
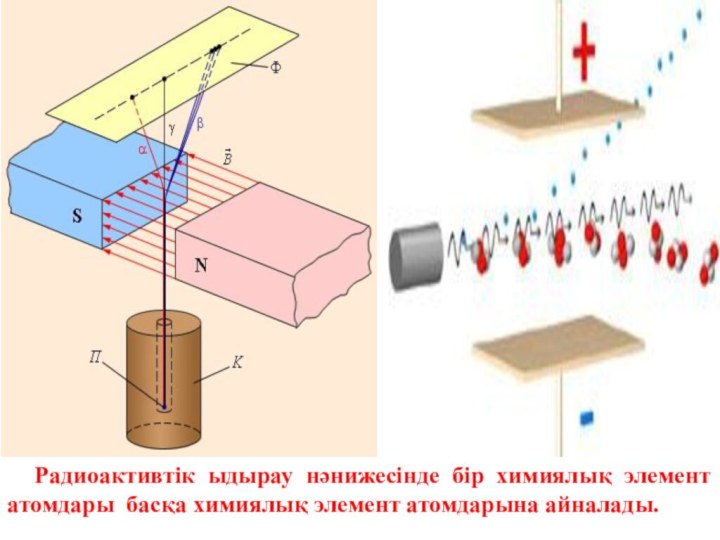
- 3. Радиоактивті сәулелердің табиғаты 3 түрлі: альфа, бетта
- 4. Радиоактивтік ыдырау нәнижесінде бір химиялық элемент атомдары басқа химиялық элемент атомдарына айналады.
- 5. Эрнест Резерфорд(1871–1937)
- 6. Атомның ішінде оң зарядты және массаның таралуының
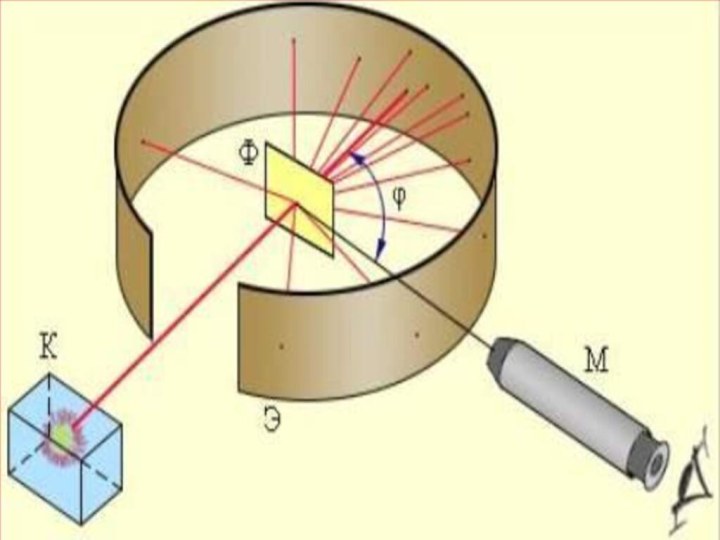
- 8. Тәжірибе барысында өте жұқа (l=6*10-7 м) алтын
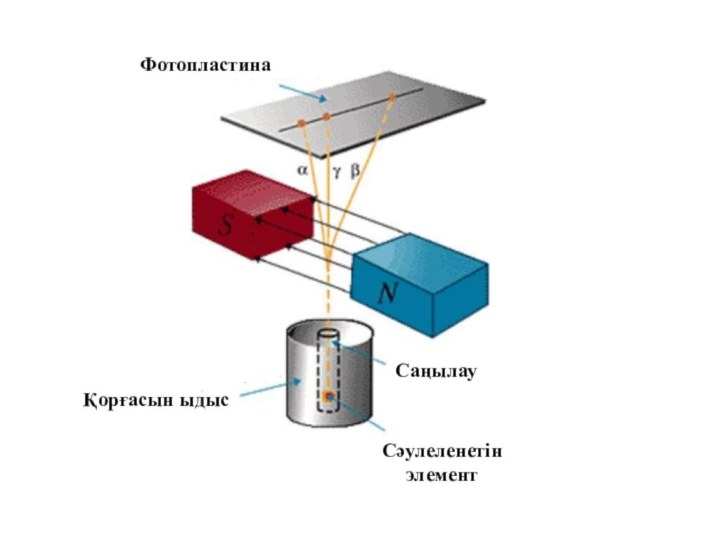
- 11. ФотопластинаҚорғасын ыдысСәулеленетін элементСаңылау
- 12. Тәжірибенің нәтижесінде альфа-бөлшектердің басым көпшілігі фольгадан өткенде
- 13. Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз
- 14. Атомның ішіндегі бос кеңістік «өте үлкен».
- 16. +++++++Алтын атомының ядросы----α - бөлшегі
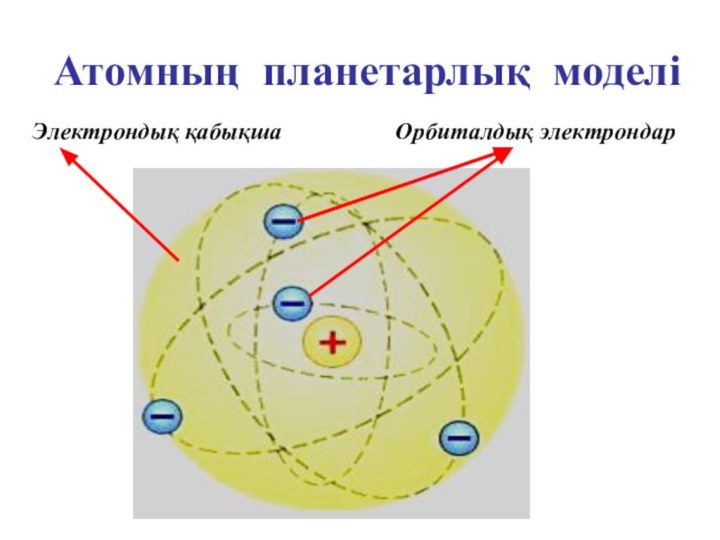
- 17. Атомның планетарлық моделі Орбиталдық электрондарЭлектрондық қабықша
- 18. qя = + Z • eZ-элементтің Менделеев
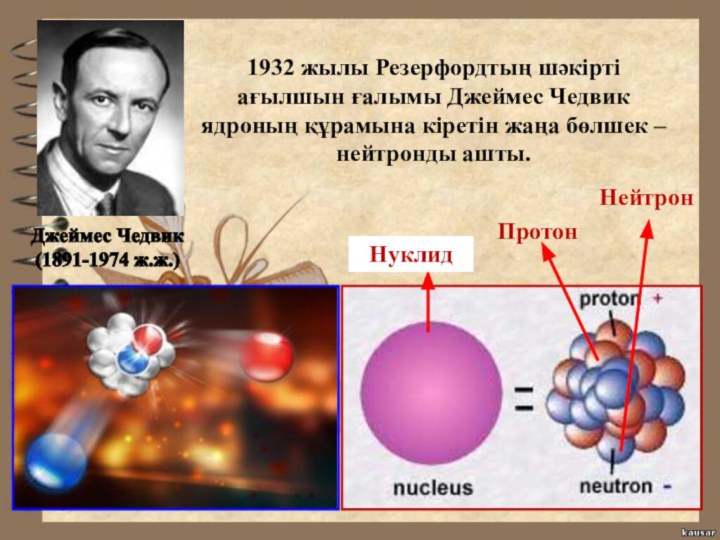
- 19. Протон Нейтрон Нуклид 1932 жылы Резерфордтың шәкірті
- 20. Химиялық элемент zХА A = N
- 21. Уран ядросының 92U238 заряды (qЯ= +92 ·
- 22. Сабақтың тақырыбы: Бор постулатттары. Сутегі тектес атом
- 23. Бөлшектердің шашырауын зерттейтін тәжірибелердің классикалық теориямен салыстырғанда
- 24. Бор постулаттары: І постулат: Атомда электрондар қозғалатын
- 26. Скачать презентацию
- 27. Похожие презентации















Слайд 3 Радиоактивті сәулелердің табиғаты 3 түрлі: альфа, бетта және
гамма сәулелері. Альфа – сәулелер гелий иондарының ағымы, бетта
– сәулелер электрондар ағымы, гамма – сәулелер толқын ұзындығы 10-11 – 10-13 м шамасындағы электромагниттік сәулелер кванттарының ағыны.Слайд 4 Радиоактивтік ыдырау нәнижесінде бір химиялық элемент атомдары басқа
химиялық элемент атомдарына айналады.
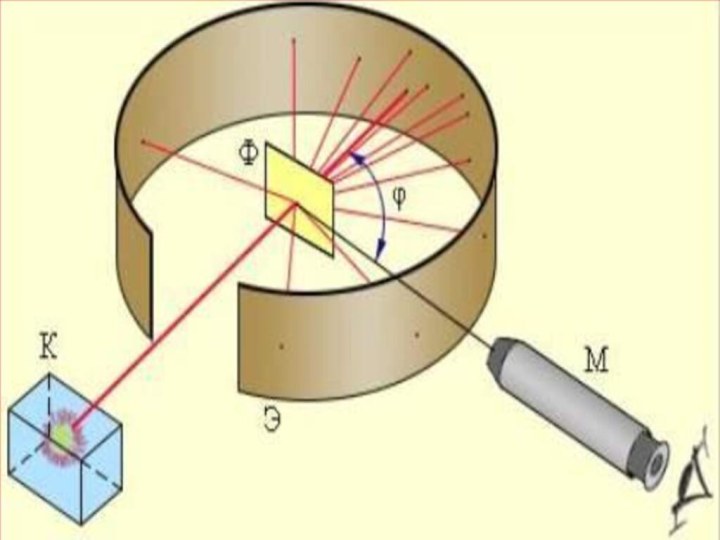
Слайд 6 Атомның ішінде оң зарядты және массаның таралуының зерттеу
үшін 1906 жылы Э.Резерфорд атомды альфа – бөлшекпен атқылауды
ұсынды. 1911 жылы ағылшын физигі Резерфорд атомның ядролық моделін ұсынды. Резерфорд өзінің шәкірттері Г.Гейгер және Э. Марсденмен бірге альфа-бөлшектер шоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді.Слайд 8 Тәжірибе барысында өте жұқа (l=6*10-7 м) алтын фольганы
энергиясы 7,68 МэВ жылдам альфа бөлшектермен атқылаған. Қорғасын контейнердің
түбінде орналасқан 21484 Ро радиоактивті элементтен шыққан альфа-бөлшектердің жіңішке шоғы алтын фольгадан өткенде шашырайды, яғни алғашқы бағытынан ауытқиды. Ол кезде альфа-бөлшектердің оң заряды (2е) гелий иондары екені белгілі болатын. Фольгадан шашыраған альфа-бөлшектердің қаншасы қандай бұрышқа ауытқығанын есептей отырып, осы ауытқуларды тудырған нысана-атомдардың құрылымы анықталады. Фольганың қалыңдығы өте аз болғандықтан, одан өткенде әрбір альфа-бөлшек тек бір атоммен ғана әсерлеседі, яғни бір-ақ рет шашырауға ұшырайды деп есептеуге болады. Шашыраған альфа-бөлшектер күкіртті цинкпен (ZnS) қапталған экранға келіп соғылады. Күкіртті цинк молекулаларының альфа-бөлшекпен соқтығысқанда сәуле шығаратын қасиеті бар. Сондықтан экранның альфа-бөлшек соғылған жерлерінде сцинтилляция, яғни өте әлсіз жарқыл байқалады. Тәжірибенің мақсаты берілген уақыт аралығында байқалатын жарқылдардың φ ауытқу бұрышына тәуелділігін анықтау.Слайд 12 Тәжірибенің нәтижесінде альфа-бөлшектердің басым көпшілігі фольгадан өткенде алғашқы
бағыттан ауытқымайтыны (φ≈1 – 2°) анықталды. Бұл нәтиже, негізінен,
Томсон моделіне сүйеніп жасалған есептеулермен дәл келді. Бірақ, альфа-бөлшектердің мардымсыз аз бөлігі 90°-тан артық бұрышқа ауытқитыны, яғни олар фольгаға соғылып, кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен! Мұны Томсон моделі негізінде түсіндіру тіпті мүмкін болмады.Слайд 13 Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін
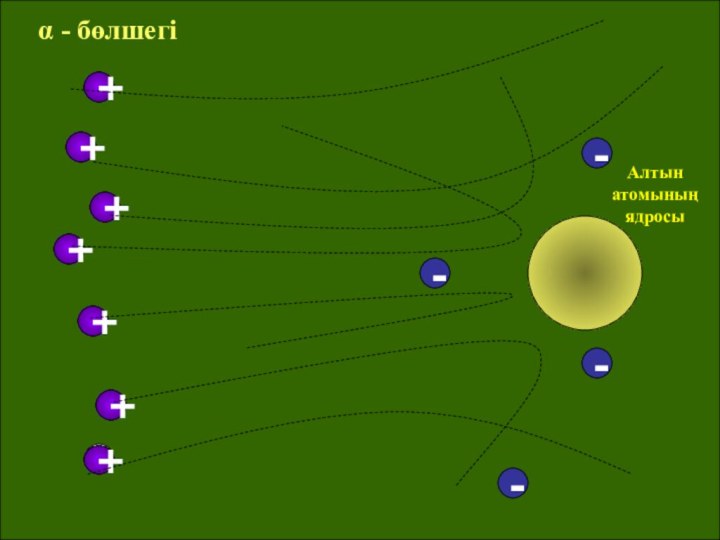
ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы
шамамен 10-15 м өте аз көлемге жинақталған деген қорытындыға келді. Бірақ орталық бөлшекті Резерфорд ядро деп атады. Атомның массасын түгел дерлік ядрода шоғырланған. Ядроны айнала әр түрлі орбиталармен электрондар қозғалып жүреді. Бұл үлгі Күн жүйесінің құрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі «бос» болып шығады, ядроның радиусы атомның радиусынан 100000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап.Слайд 14 Атомның ішіндегі бос кеңістік «өте үлкен». Сондықтан,
фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де,
шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесіп, кері ұшады. Мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады.
Слайд 18
qя = + Z • e
Z-элементтің Менделеев кестесіндегі
реттік саны, протон саны;
Ядроның өлшемі, заряды
Ядроның диаметрі 10-12 -
10-13 см,атомның диаметрі 10-8 см
qэ = - Z • e
- әрбір электронның немесе протонның заряды бір элемен-тар зарядқа (е =-1,6 • 10 -19Кл) тең;
- кез келген элемент атомының ядросындағы протондар са-ны сол элементтің Менделеев кестесіндегі Z реттік санына тең.
Z =1 Z=92
Слайд 19
Протон
Нейтрон
Нуклид
1932 жылы Резерфордтың шәкірті ағылшын
ғалымы Джеймес Чедвик ядроның құрамына кіретін жаңа бөлшек –
нейтронды ашты.
Слайд 20
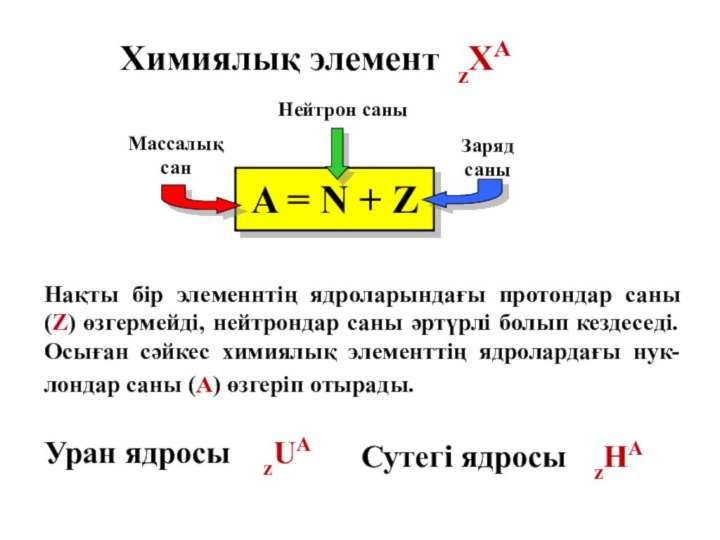
Химиялық элемент zХА
A = N +
Z
Сутегі ядросы zНА
Уран ядросы zUA
Нақты бір элеменнтің ядроларындағы протондар саны (Z) өзгермейді, нейтрондар саны әртүрлі болып кездеседі. Осыған сәйкес химиялық элементтің ядролардағы нук-лондар саны (А) өзгеріп отырады.
Массалық сан
Заряд саны
Нейтрон саны
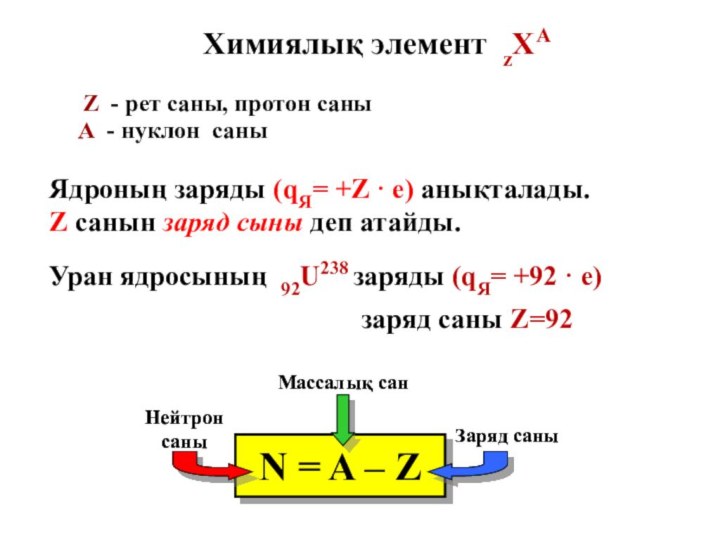
Слайд 21 Уран ядросының 92U238 заряды (qЯ= +92 · е)
Химиялық элемент zХА
Z - рет саны, протон саны
А - нуклон саны
заряд саны Z=92
Ядроның заряды (qЯ= +Z · е) анықталады. Z санын заряд сыны деп атайды.





























