двумя параметрами газа при неизменном значении третьего.
Газовые законы
справедливы для любых газов и газовых смесей.Газовые законы
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть














Газовые законы
Уравнение Менделеева -Клапейрона
Уравнение Клапейрона
Бенуа́ Поль Эмиль Клапейрон — французский физик и инженер.
Изопроцессы
Эдм Мариотт
Закон получен экспериментально
в 1662 Р. Бойлем
в 1676 Э. Мариоттом
Закон Бойля-Мариотта
pV= const при T=const и m=const
Закон Бойля-Мариотта
Закон Гей-Люссака
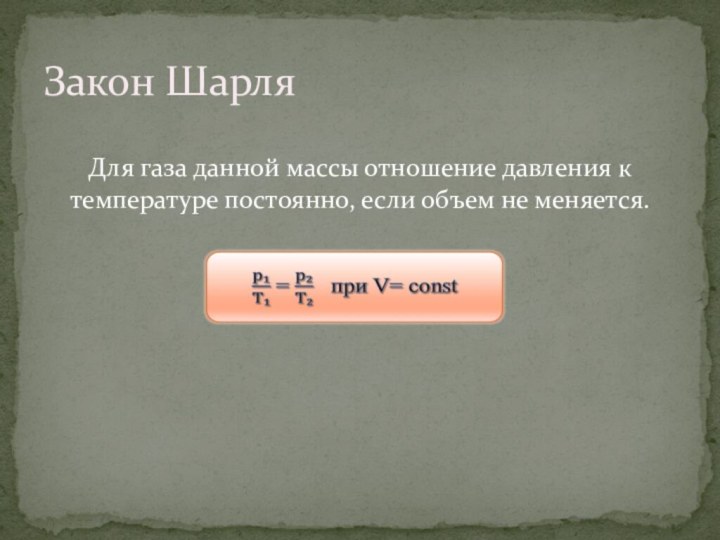
Закон Шарля