из создателей современной физики.
Основатель (1920) и руководитель Института
теоретической физики в Копенгагене (Институт Нильса Бора); создатель мировой научной школы; иностранный член АН СССР (1929).
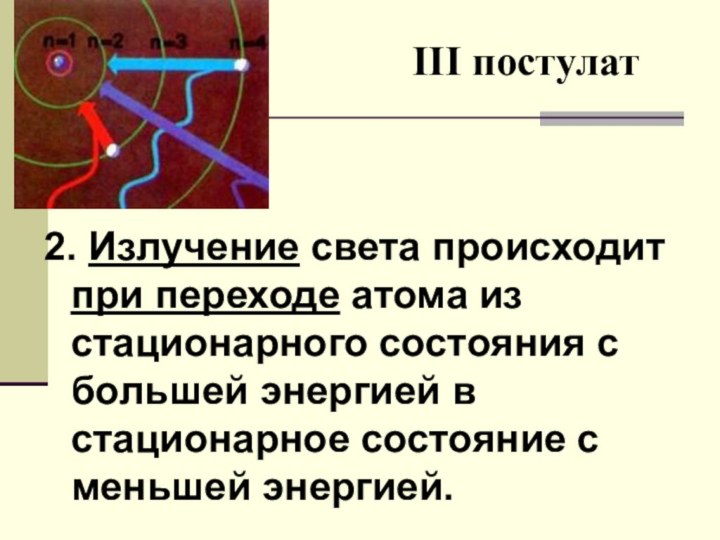
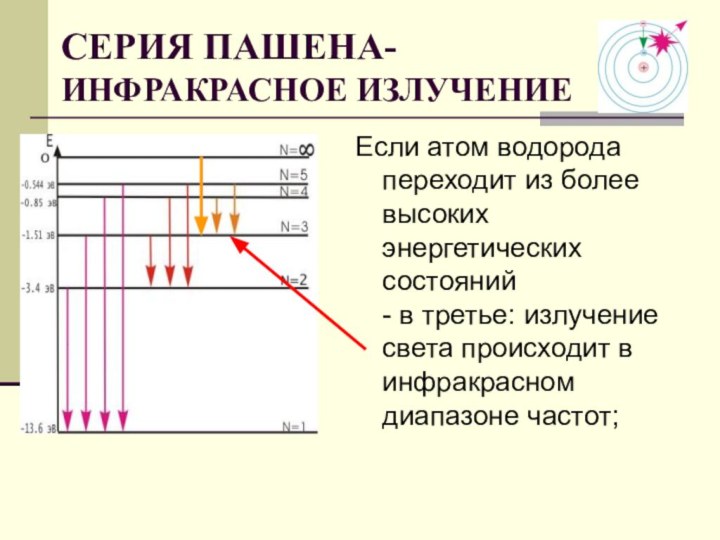
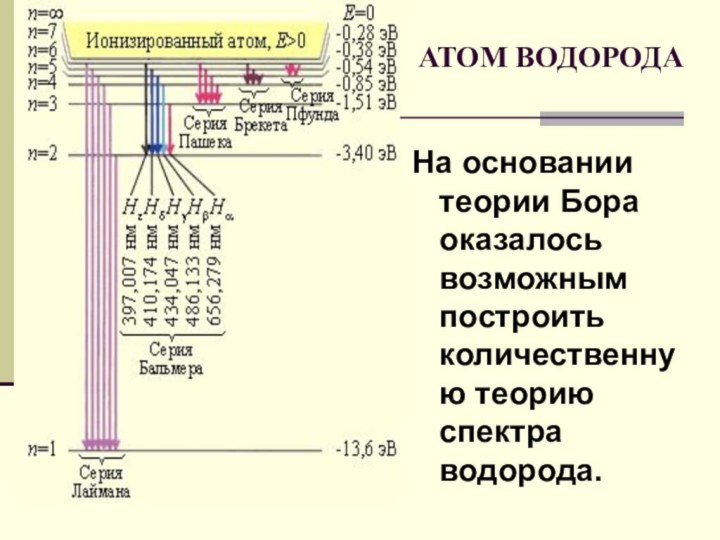
Создал теорию атома,
в основу которой легли планетарная модель атома,
квантовые представления и предложенные им постулаты.
Важные работы по теории металлов, теории атомного ядра и ядерных реакций.