- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азотная кислота
Содержание
- 2. «Азотная кислота»Тема урока:
- 3. I. Строение молекулы
- 4. По основности:
- 5. Ж., з., ρ = 1,51 г/см3, tпл
- 6. «Азотная кислота по характеру среди
- 7. I. Общие с другими кислотами
- 8. С основными оксидамиCuO + 2HNO3 = Cu(NO3)2 + H2OCuO
- 9. С основаниями (нерастворимыми):Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2OCu(OH)2 + 2H++
- 10. С растворимыми основаниямиNaOH + HNO3 = NaNO3+ H2ONa+ +
- 11. C солями (более слабых кислот):Na2CO3 + 2HNO3 = 2NaNO3 +
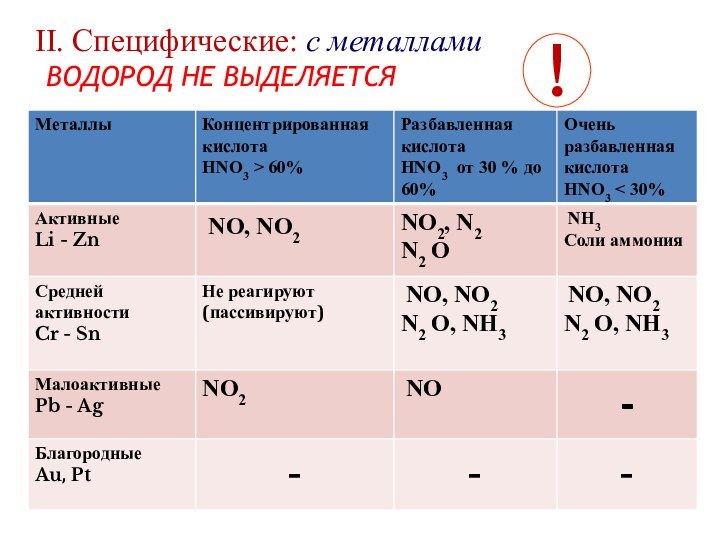
- 12. II. Cпецифические: с металлами ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ!
- 13. Схема уравненияМе +HNO3 = соль +
- 14. 4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O
- 15. 4HNO3 = 4 NO2 + 2 H2O + O2.
- 16. Получение
- 17. 1. Схема последовательного
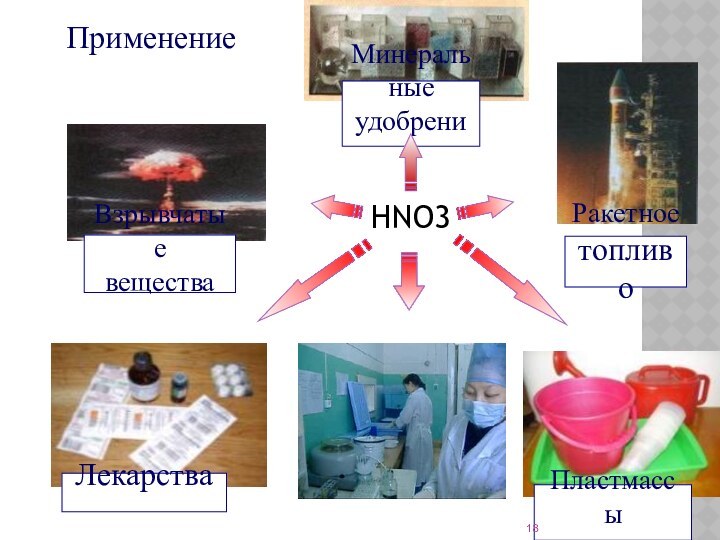
- 18. Применение HNO3
- 19. Согласны ли вы со следующими утверждениями:
- 20. ПРОВЕРЬ СЕБЯ !1. Да2. Нет 3. Да
- 21. Скачать презентацию
- 22. Похожие презентации








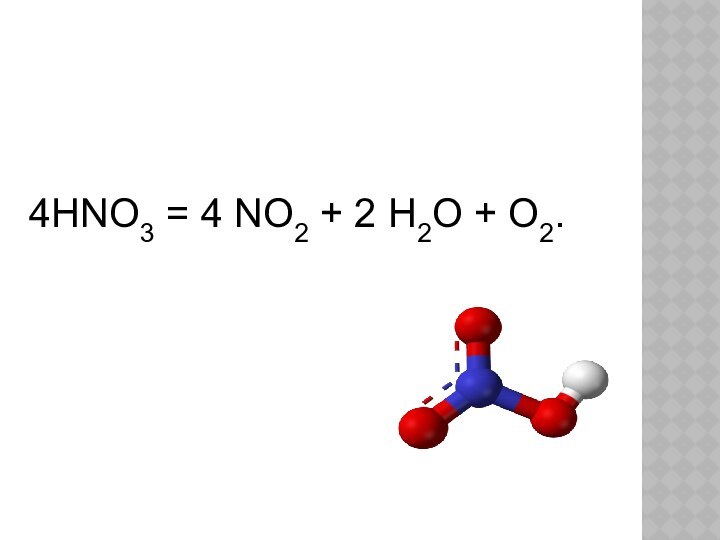





Слайд 3
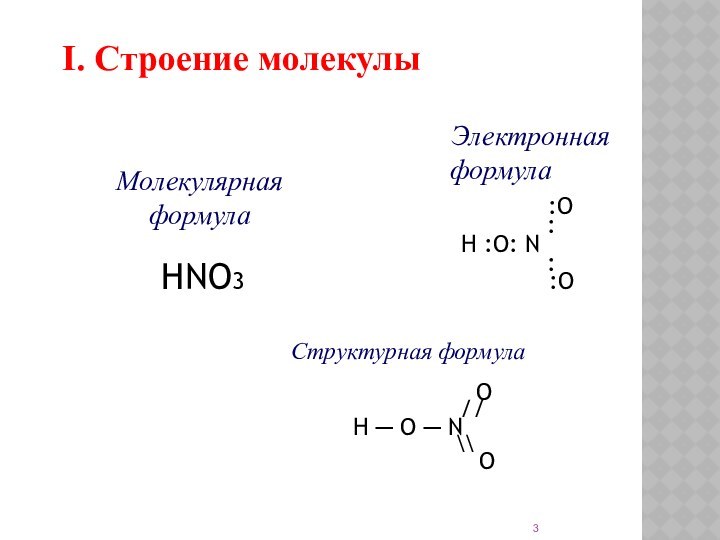
I. Строение молекулы
Электронная формула
:O
:
H :O: N
:
:O
Структурная формула
O
//
H ─ O ─ N
\\
O
Молекулярная формула
HNO3
Слайд 4
По основности:
одноосновная
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По стабильности:
нестабильная
По летучести:
летучая
По степени диссоциации:
сильная
II. Характеристика кислоты
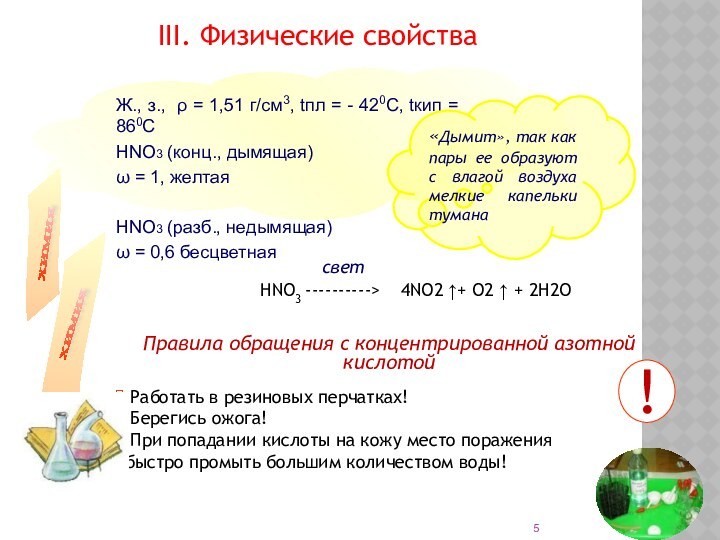
Слайд 5 Ж., з., ρ = 1,51 г/см3, tпл =
- 420С, tкип = 860С
НNO3 (конц., дымящая)
ω =
1, желтаяНNO3 (разб., недымящая)
ω = 0,6 бесцветная
III. Физические свойства
Правила обращения с концентрированной азотной кислотой
«Дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана
HNO3 ---------->
Работать в резиновых перчатках!
Берегись ожога!
При попадании кислоты на кожу место поражения быстро промыть большим количеством воды!
свет
!
4NO2 ↑+ O2 ↑ + 2H2O
Слайд 6
«Азотная кислота по характеру среди своих
подруг - самая сильная и уверенная в себе .
Внешне это не проявляется»III. Химические свойства
II. Специфические свойства
I. Общие с другими кислотами
Слайд 7
I. Общие с другими кислотами
НNO3 + лакмус фиолетовый
= НNO3 + метиловый оранжевый =
НNO3 ?
H+ + NO3-
Слайд 8
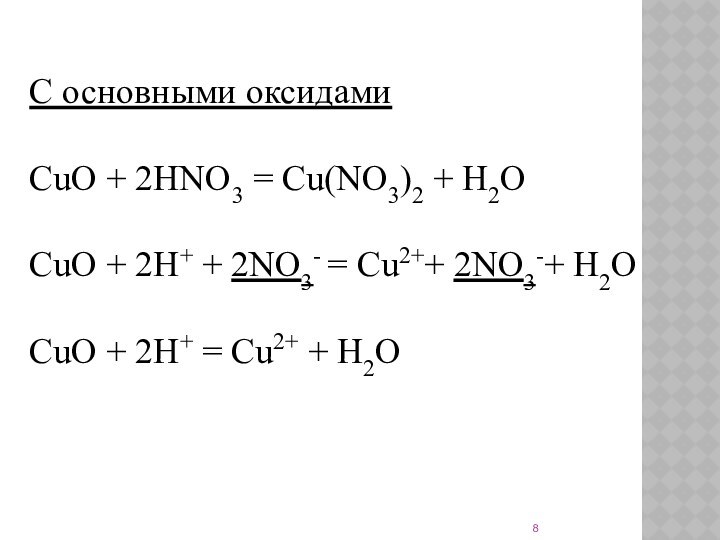
С основными оксидами
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO +
2H+ + 2NO3- = Cu2++ 2NO3-+ H2O
CuO + 2H+ = Cu2+ +
H2O
Слайд 9
С основаниями (нерастворимыми):
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H++ 2NO
3- = Cu2+ + 2NO3- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ +
2H2O
Слайд 10
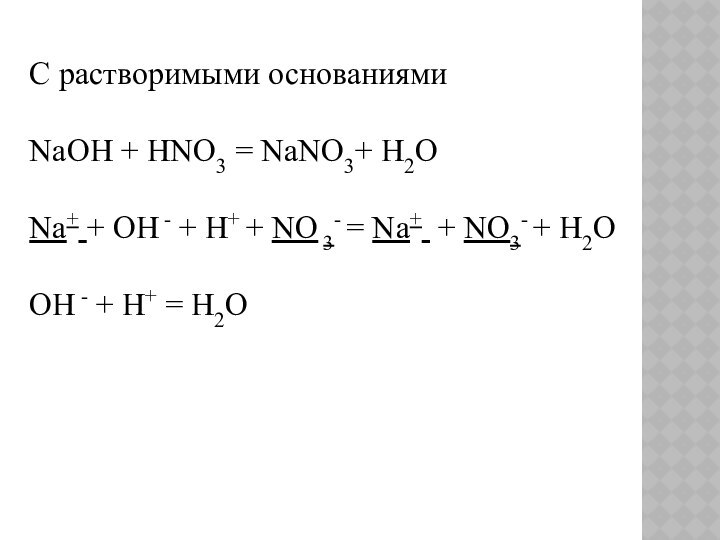
С растворимыми основаниями
NaOH + HNO3 = NaNO3+ H2O
Na+ + OH
- + H+ + NO 3- = Na+ + NO3-
+ H2OOH - + H+ = H2O
Слайд 11
C солями (более слабых кислот):
Na2CO3 + 2HNO3 = 2NaNO3 + CO2+
H2O
2Na+ + CO32 - + 2H+ + 2NO3- =
2Na ++ 2NO3-+ CO2 ↑ + H2OCO32- + 2H+ = CO2 ↑ + H2O
Слайд 13
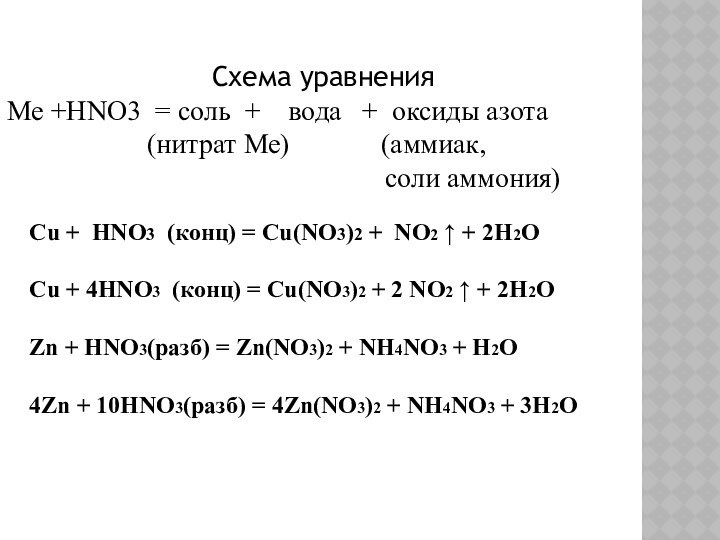
Схема уравнения
Ме +HNO3 = соль + вода
+ оксиды азота
(нитрат Ме) (аммиак, соли аммония)
Cu + HNO3 (конц) = Cu(NO3)2 + NO2 ↑ + 2H2O
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2 NO2 ↑ + 2H2O
Zn + HNO3(разб) = Zn(NO3)2 + NH4NO3 + H2O
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Слайд 16
Получение
ГЛАУБЕР Иоганн Рудольф (1604-1670),
немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году.
Завод азотной кислоты
NaNO3 + H2SO4 = NaHSO4 + HNO3
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
Слайд 17 1. Схема последовательного получения
азотной кислоты:
Промышленный способ получения азотной кислоты
2. Химические реакции:1
2
3
4NH3 + 5О2 = 4NO + 6Н2О + Q
2NO + O2 = 2NO2 + Q
NO2 + H2O = 2HNO3 + NO↑ + Q
Слайд 19
Согласны ли вы со следующими утверждениями:
?
1. Азотная кислота является
сильным окислителем.2. Азотная кислота взаимодействует только с растворимыми основаниями.
3. Азотная кислота разлагается на свету.
4. Соли азотной кислоты называются нитритами.
5. Азотная кислота взаимодействует только с металлами стоящими в ряду активности до водорода.
6. Азотная кислота пассивирует алюминий.
7. Азотную кислоту в промышленности получают из аммиака.
8. При взаимодействии азотной кислоты с металлами водород не выделяется.





























