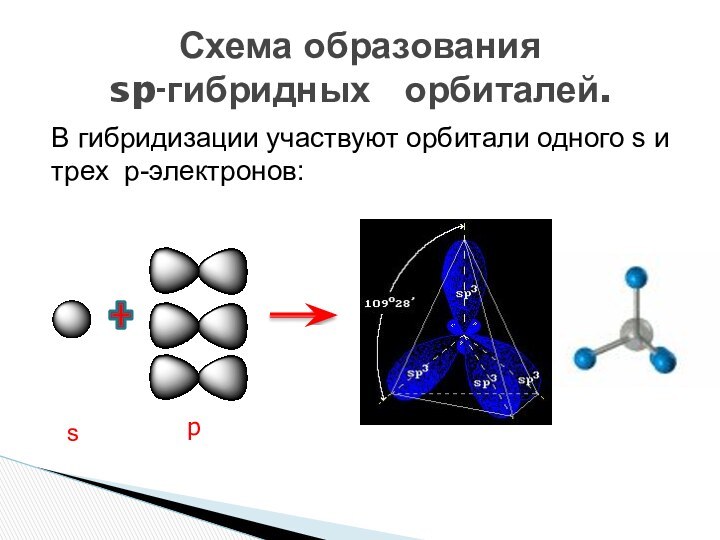
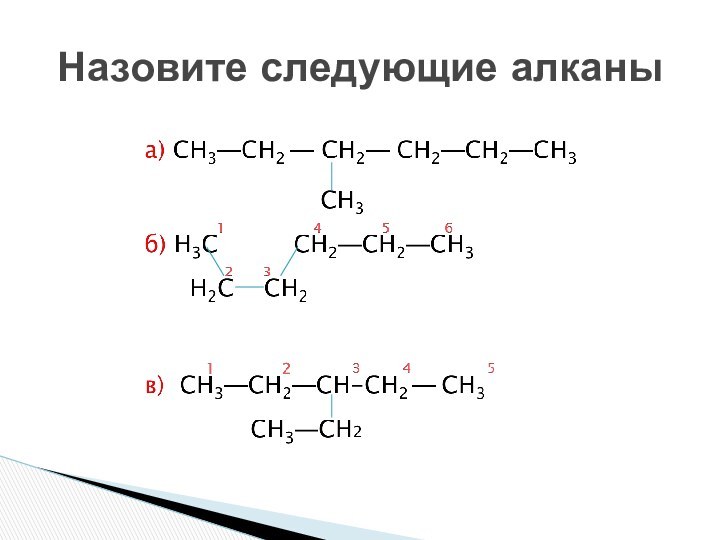
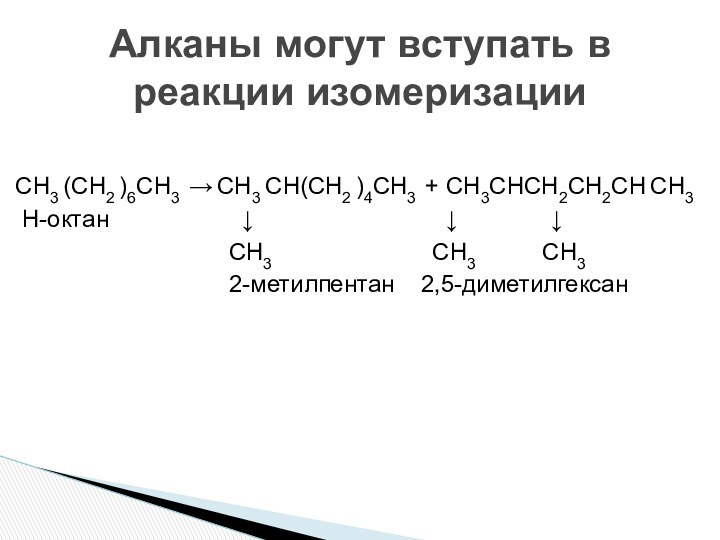
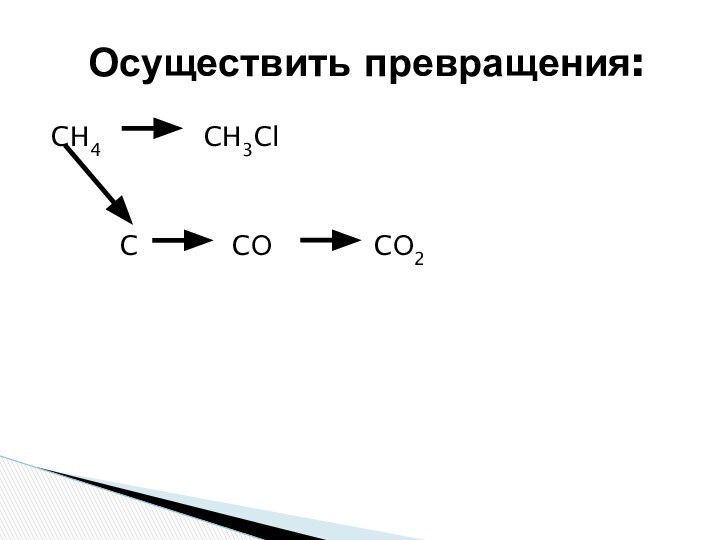
состоянии углерода.
Вы познакомитесь с особенностями предельных углеводородов,
с
понятиями – гомолог, гомологический ряд, гомологическая разница, номенклатура. Вы узнаете важнейшие свойства углеводородов данного класса.
Вы научитесь строить молекулы веществ по названиям и называть вещества по формулам, составлять формулы гомологов.
Вы узнаете значение предельных углеводородов в жизни человека и области использования метана.
Вы еще раз убедитесь, что нужны знания и умения при решении проблемной задачи с экологическим содержанием.
Мы поговорим о воздействии метана на здоровье человека.
Вы приятно удивитесь: оказывается, вы знаете уже так много!
Сегодня на уроке