Слайд 2
При всем разнообразии функций, реализация функции белков всегда
базируется на
высоко специфическом — как у ключа с
замком — взаимодействии белка с
обрабатываемой им молекулой. Для специфического взаимодействия необходима
достаточно "твердая" пространственная структура. Поэтому биологическая функция
белков тесно связана с наличием определенной трехмерной структуры молекулы.
Знание молекулярной трехмерной структуры белка необходимо для понимания механизма функционирования белковой молекулы.
Поэтому, прежде всего, следует обсудить структуру белковой молекулы, природу ее
стабильности и способности к самоорганизации. Обычно при рассмотрении пространственной организации биополимеров (белков и
нуклеиновых кислот) выделяют четыре уровня: первичную, вторичную, третичную и
четвертичную структуры.
Слайд 3
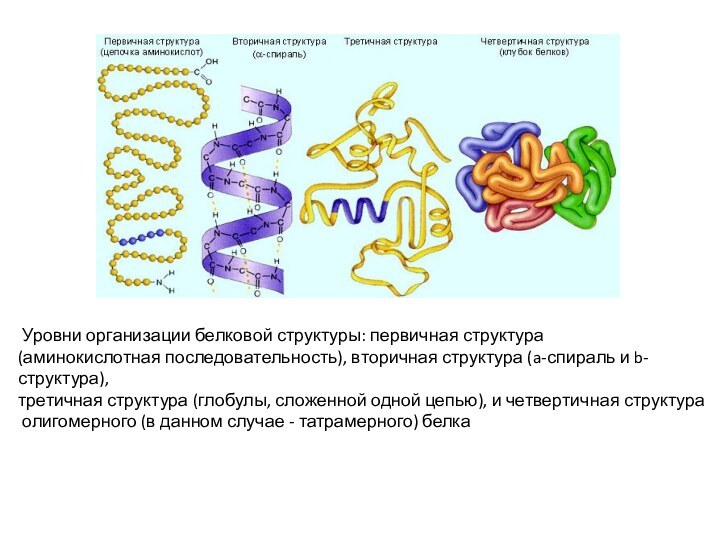
Уровни организации белковой структуры: первичная структура
(аминокислотная
последовательность), вторичная структура (a-спираль и b-структура),
третичная структура (глобулы,
сложенной одной цепью), и четвертичная структура
олигомерного (в данном случае - татрамерного) белка
Слайд 4
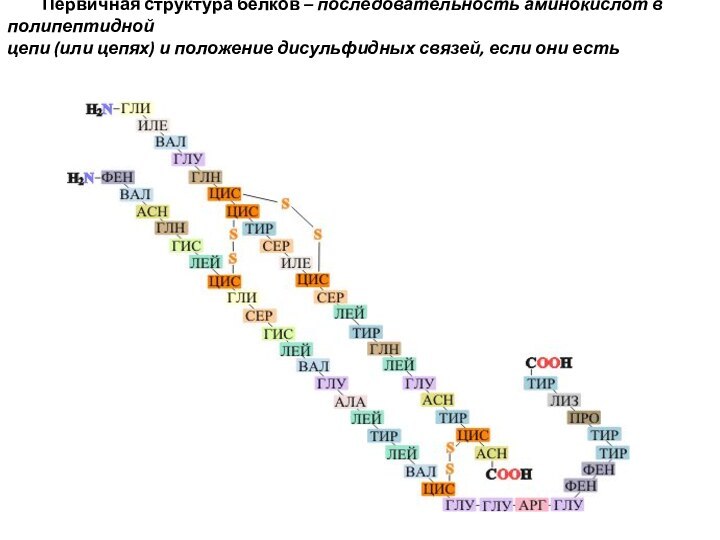
Первичная структура белков – последовательность аминокислот в полипептидной
цепи (или цепях) и положение дисульфидных связей, если они
есть
Слайд 5
Свойства первичной структуры:
1) Последовательность аминокислот в первичной структуре
белка является
специфической видовой характеристикой данного белка.
2) Первичная структура
белка является основой для формирования последующих
структур белка за счёт взаимодействия радикалов аминокислотных остатков
полипептидной цепи.
Слайд 6
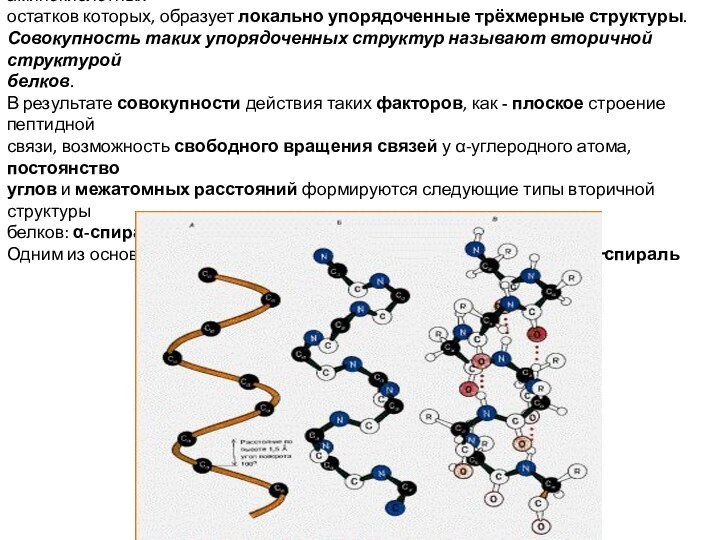
Часто в полипептидных цепях содержатся участки, последовательность аминокислотных
остатков которых, образует локально упорядоченные трёхмерные структуры.
Совокупность таких
упорядоченных структур называют вторичной структурой
белков.
В результате совокупности действия таких факторов, как - плоское строение пептидной
связи, возможность свободного вращения связей у α-углеродного атома, постоянство
углов и межатомных расстояний формируются следующие типы вторичной структуры
белков: α-спираль, β-структура и β-складка.
Одним из основных элементов вторичной структуры белков является α‑спираль
Слайд 7
Это — правая спираль, которую можно себе представить

в виде пептидной цепи,
закрученной вокруг воображаемого цилиндра.
Характеристики
α-пирали:
- содержит 3,6 аминокислотного остатка на виток с периодом повторяемости 5,4 нм;
- полипептидный остов образует плотные витки вокруг длинной оси молекулы;
- боковые радикалы выступают наружу;
- спираль удерживается водородными связями между группами N-H одной пептидной
связи и кислородом группы С=О, принадлежащей другой пептидной связи, расположенной через четыре аминокислотных остатка над первой в следующем витке спирали;
- в α-спирали полностью использована возможность образования водородных связей
(внутримолекулярные), поэтому она не способна образовывать водородные связи с
другими элементами вторичной структуры.
Степень спирализации в белках колеблется от 5 до 80%. Для некоторых белков, например,
для цитохрома С, α-спираль лежит в основе пространственной структуры, другие,
например, химотрипсин, не имеют α‑спирализованных участков.
(При графическом изображении спиральные участки изборажаются цилиндром).
Слайд 8
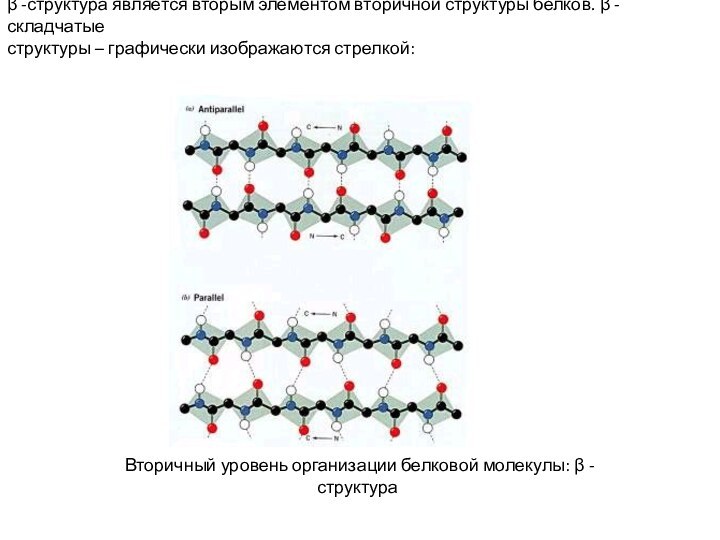
β -структура является вторым элементом вторичной структуры белков.
β -складчатые
структуры – графически изображаются стрелкой:
Вторичный
уровень организации белковой молекулы: β -структура
Слайд 9
Характеристика β-структуры:
- остов полипептидной цепи в β-структуре вытянут
таким образом, что имеет уже не
спиральную, а зигзагообразную,
складчатую форму;
- боковые группы аминокислотных остатков (R-группы) направлены перпендикулярно
плоскости складчатого слоя и расположены выше и ниже него;
- в отличие от α-спирали β-структура образована за счет межцепочечных водородных
связей между соседними участками полипептидной цепи, так как внутрицепочечные
контакты отсутствуют.
Если эти участки направлены в одну сторону, то такая структура называется параллельной, если же в противоположную, то - антипараллельной.
- в отличие от α-спирали, насыщенной водородными связями, каждый участок
полипептидной цепи в β‑конформации открыт для образования дополнительных
водородных связей.
Слайд 10
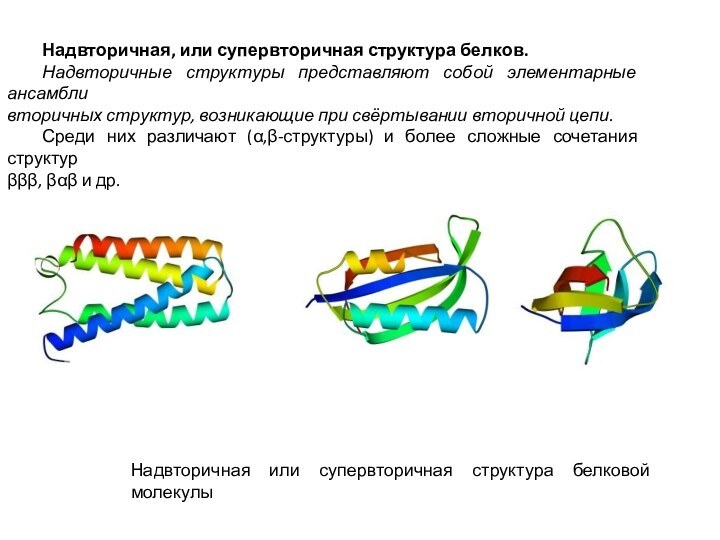
Соотношение между различными типами вторичных структур в составе
белков варьирует
в широких приделах, причём доля неупорядоченных структур
часто превалирует над
регулярными – α-спиралью и β-структурой.
В области неупорядоченных структур достаточно протяжённые зоны представлены петлями и резкими изгибами.
Наиболее часто встречаются так называемые β-изгибы, когда полипептидная цепь резко
меняет своё направление на 180º.
Этот изгиб по форме напоминает шпильку для волос и стабилизируется одной водородной
связью.
В областях β-изгибов преобладают главным образом спиральнеобразующие
(имеющие наименьший боковой радикал) аминокислоты – пролин и глицин.
!!! Какую именно конформацию принимают участки полипептидной цепи (α-спираль,
β‑складку, β-изгиб или остаются неструктурированными), в значительной степени
определяется первичной последовательностью полипептидной цепи.